Воспалительные заболевания кишечника, такие как язвенный колит и болезнь Крона, представляют собой серьезную проблему современной медицины, оказывая значительное влияние на качество жизни миллионов людей по всему миру. Традиционные методы лечения, основанные на подавлении иммунного ответа и использовании противовоспалительных средств, зачастую обладают ограниченной эффективностью и вызывают нежелательные побочные эффекты. В связи с этим учёные активно ищут инновационные биотехнологические решения для более точной и эффективной терапии. Одним из самых перспективных направлений является использование ло́кд-нуклеиновых кислот (LNA, locked nucleic acids) - особого класса модифицированных антисмысловых олигонуклеотидов, которые способны высокоспецифично связываться с целевыми участками мРНК и регуляторными последовательностями. Высокое сродство этих молекул к нативной РНК позволяет значительно повысить точность и эффективность воздействия на экспрессию генов, участвующих в развитии воспалительных процессов.
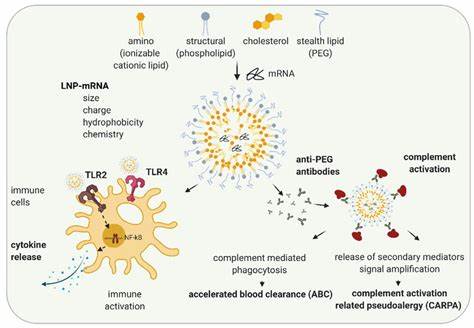
Однако несмотря на преимущества LNA, их клиническое применение сопровождается рядом ограничений, главным из которых является необходимость использования высоких доз препаратов для достижения терапевтического эффекта. Это сопряжено с риском токсичности, нежелательного влияния на другие органы и снижением безопасности лечения в целом. Для преодоления этих трудностей ключевым становится разработка инновационных систем доставки, способных обеспечить направленное и защищенное проникновение LNA в ткани кишечника. Липидные наночастицы (LNPs) представляют собой современную и высокоэффективную платформу для транспортировки нуклеиновых кислот. Они состоят из комбинации ионизируемых липидов, холестерина, ПЭГ-липидов и вспомогательных компонентов, формирующих стабильные наночастицы с гидродинамическим диаметром около 50-70 нанометров.
Главная особенность LNP - их способность изменять заряд в зависимости от pH среды, что позволяет защищать загруженный нуклеиновой кислоты материал в крови и обеспечивать эффективный выход из клеточных эндосом при попадании внутрь клетки. Недавно была продемонстрирована успешная разработка серии LNP, содержащих специально синтезированные ионизируемые липиды, оптимизированные для доставки LNA в кишечник. В ходе исследований был разработан комплекс из восьми различных липидов, каждый из которых имеел уникальную химическую структуру соединительных и гидрофобных компонентов. Из них была выделена группа наиболее эффективных и безопасных представителей, обеспечивающих высокую степень инкапсуляции и стабильность наночастиц, а также низкий уровень токсичности при взаимодействии с клетками. Терапевтическая эффективность LNP с LNA была проверена на множестве моделей, включая культуре клеток и мышах с индуцированным колитом.
Для оценки активности использовали анти-сплайсинг LNA, направленные на регулировку альтернативного сплайсинга гена фактора индуцируемого гипоксией Hif1α, что служило чувствительным маркером доставки и функциональной активности молекул. Результаты показали, что LNP существенно увеличивают эффективность LNA, позволяя сократить необходимую дозу более чем в 30 раз относительно свободных олигонуклеотидов. Кроме того, в модели воспалительного заболевания кишечника у мышей, индуцированной с помощью сульфата декстрана натрия (DSS), было показано, что инъекции LNP с LNA, нацеленными против мРНК провоспалительного цитокина опухолевого некротического фактора альфа (TNFα), приводят к выраженному снижению выраженности воспаления. Животные, получающие такую терапию, демонстрировали меньшую потерю массы тела, уменьшение укорочения кишечника - классического симптома воспаления, а также значительное снижение уровней ключевых провоспалительных цитокинов, таких как IL-6 и IL-1β. Морфологический анализ тканей подтвердил сохранность слизистой оболочки и снижение инфильтрации лейкоцитов, что свидетельствует о восстановлении гистологической структуры.
Огромное значение для клинического применения имеет безопасность системы доставки. LNP, разработанные для LNA, обладали весьма благоприятным профилем безопасности - у животных не наблюдалось существенного повышения уровня печеночных ферментов, нетоксичности со стороны кроветворной системы и других побочных реакций. Таким образом, применение LNP как переносчиков значительно расширяет возможности терапии LNA, снижая дозы и потенциальные риски. Настоящий прогресс становится возможным благодаря комплексным знаниям в области химии липидов, молекулярной биологии и нанотехнологий. Синтез и выбор ионизируемых липидов с линолеиновыми цепями, биодеградируемыми сложными эфирами и различными аминогруппами влияет на стабильность, размер и pKa частиц, а значит, и на эффективность доставки.
Оптимальный диапазон pKa (6.0-6.9) способствует максимальному связыванию LNA под кислотными условиями и освобождению внутри клетки. Таким образом, разработка новых липидов играет ключевую роль в создании успешных LNP-клинических систем. Важной особенностью LNP является их естественное распределение в организме при системном введении, которое захватывает печень и селезенку, однако при воспалении кишечника благодаря нарушению барьерных функций и изменению сосудистого проницаемого барьера наблюдается значительное накопление в кишечнике.
Это обеспечивает потенциально направленную доставку и повышает локальный эффект. С другой стороны, определённые структуры и поверхности LNP можно дополнительно модифицировать для активного таргетинга конкретных клеточных типов кишечника, например, иммунных клеток - макрофагов, нейтрофилов, или эндотелиальных клеток, которые играют критическую роль в патогенезе IBD. Перспективы развития методов доставки LNA с использованием LNP включают интеграцию активных методов таргетинга, использование новых липидов с улучшенным профилем деградации, а также сочетание с другими терапевтическими агентами. Применение таких технологий позволит более точно влиять на специфическую генную регуляцию в очагах воспаления, снизив системную нагрузку и риск токсичности. Современные нанотехнологические подходы с LNP выводят на новый уровень терапию воспалительных заболеваний кишечника, позволяя обойти ограничения системных препаратов и обеспечить доставку генетических лекарств прямо в воспалённые клетки.
Это открывает новые горизонты для персонализированной медицины, где можно контролировать активность отдельных генов и таким образом направленно устранять воспаление без обширного подавления иммунной системы. Таким образом, использование ло́кд-нуклеиновых кислот в сочетании с липидными наночастицами - инновационный и перспективный путь для эффективного лечения воспалительных заболеваний кишечника. Этот подход не только увеличивает специфичность и эффективность терапевтического воздействия, но и значительно улучшает безопасность лечения, благодаря значительному снижению необходимых доз и возможности локализованной доставки. В сочетании с дальнейшими исследованиями по оптимизации конструкции LNP и расширению спектра целевых молекул, такие технологии имеют потенциал коренным образом изменить подход к терапии хронических воспалительных заболеваний в ближайшем будущем. .