Современная наука активно движется в направлении создания и манипулирования большими участками ДНК, что открывает широкие возможности для изучения фундаментальных процессов биологии развития, генетической регуляции и эпигенетики. Одним из наиболее впечатляющих достижений в этой области стало успешное синтетическое создание мегабазовых участков человеческой ДНК и их доставка в эмбрионы мышей для глубокого исследования процессов эпигенетической регуляции с нуля. Технология синтеза и сборки мегабазовых участков человеческой ДНК, несмотря на сложность и масштаб проекта, позволила воспроизвести человеческие геномные фрагменты с высокой степенью точности в модели организма мыши. Это дало уникальную возможность наблюдать, как клеточная среда млекопитающих взаимодействует с полностью искусственным, чистым от фрагментов эпигенетической информации, генетическим материалом. Изначально процесс сборки огромных участков ДНК сталкивался с одной из главных проблем — стабильным поддержанием в клеточном хозяине таких длинных и зачастую сильно повторяющихся последовательностей.
Важно отметить, что распространённые методы клонирования в бактериях Escherichia coli ограничены длиной и степенью повторяемости клонируемых фрагментов, что делает невозможным хранение участков длиной свыше нескольких сотен килобаз. Такое ограничение привело к поиску альтернативных организмов-хозяев, которые могли бы обеспечить надежную сборку и поддержку в естественном состоянии мегабазовых синтетических человеческих последовательностей. В этой связи дрожжи Saccharomyces cerevisiae доказали свою эффективность как универсальный биотехнологический инструмент. Благодаря уникальному механизму гомологичной рекомбинации они способны собирать большие фрагменты ДНК из множества коротких синтезированных молекул. Применение комбинированных стратегий сборки позволило собрать человеческий участок длиной более миллиона пар оснований, включающий сложно повторяющиеся элементы, с высоким уровнем точности и стабильности.
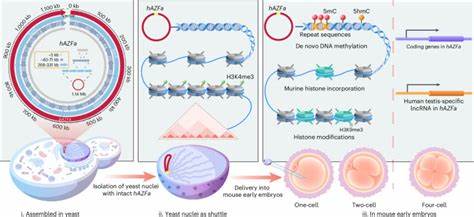
Однако создание и сборка синтетической мегабазовой ДНК — это только половина дела. Ключевой задачей стало обеспечение эффективной, точной и сохранной доставки данной ДНК в клетки млекопитающих, а именно — в эмбрионы мышей на самых ранних этапах развития. Это позволило бы наблюдать природные процессы «перезагрузки» эпигенетического состояния ДНК, понять механизмы формирования новых метилировочных и гистоновых отметок, регулирующих экспрессию генов. Для решения данной задачи разработан уникальный метод SynNICE, предусматривающий изоляцию ядер дрожжей, в которых сохранены синтетические хромосомные конструкции без разрушения нуклеосомной структуры. Использование ядерных оболочек дрожжей в качестве защитного «футляра» предотвращает разрушение длинной ДНК при пересадке в эмбрионы.
Микроинъекции ядер изолированных дрожжей в метафазные ооциты мышей позволяют перенести синтетический человеческий участок в живую среду, в которой наблюдается реструктуризация и ремоделирование хроматина. Эксперименты показали, что после доставки в мышиный эмбрион происходит быстрая замена дрожжевых гистоновых белков на консервативные гистоны мыши с возникновением новых эпигенетических меток, в частности, метилирования ДНК и модификации гистонов. Особое внимание уделялось процессу де novo метилирования ДНК, который играет ключевую роль в подавлении транскрипционной активности повторяющихся последовательностей и распределении активности генов. Полученный синтетический фрагмент, лишенный исходных эпигенетических меток, испытывал формирование совершенно нового, животного специфического мелконастройного паттерна метилирования, что является важным свидетельством успешной интеграции и регуляции чужеродного человеческого генетического материала в живую ткань. Интересным примером для исследований стал участок человеческого Y-хромосомного геномного региона AZFa, известного своей ролью в развитии мужской фертильности.
Сложность данного региона обусловлена наличием большого количества высокоповторяющихся последовательностей, что традиционно затрудняло его изучение. Создание полностью искусственного варианта AZFa позволило не только стабильно хранить данный регион в дрожжах, но и наблюдать его поведение после переноса в эмбрионы мышей, что значительно расширяет наши знания о регуляции мужского пола генов. Особое внимание уделялось анализу транскрипционной активности синтетического человеческого участка. Выяснилось, что гены на участке AZFa начинают экспрессироваться на стадии четырехклеточного эмбриона мыши, демонстрируя, что регуляция активности генов обусловлена клеточной средой, а не только исходной последовательностью ДНК. Это открывает новые горизонты для исследования межвидовой регуляции и эпигенетического программирования.
Методика SynNICE и связанный с ней разносторонний подход к созданию и доставке синтетической ДНК дают исследователям мощный инструмент для изучения фундаментальных вопросов биологии развития, эпигенетики и инженерии геномов. В перспективе данный подход может быть применен для создания искусственных хромосом, детального изучения патогенеза заболеваний, связанных с мутациями в сложно повторяющихся геномных областях, и даже для разработки новых методов генной терапии. Надежность и стабильность синтетических конструкций подтверждены многократными экспериментальными проверками, включая секвенирование, электрофоретические методы и методы многомасштабного анализа структуры хроматина. Хранение в изолированных дрожжевых ядрах обеспечивает сохранение естественной нуклеосомной упаковки, что существенно влияет на успешную интеграцию и эпигенетическую регуляцию в эмбриональных клетках. Нельзя не отметить и важность открытия связи между наличием повторяющихся элементов в ДНК и традицией их усиленного метилирования при де novo формировании эпигенетических отметок.
Такой механизм, отображенный на синтетическом человеческом фрагменте, свидетельствует о глубоко консервативных природных процессах дегустации и «распознавания» элементов генома, что важно для поддержания геномной стабильности и предотвращения нежелательной активности ретротранспозонов. В итоге, реализованная стратегия представляет собой значительный шаг вперед в области синтетической биологии, объединяя достижения химического синтеза ДНК, микробиологические методы сборки, тонкие биофизические техники изоляции ядер и инновационную молекулярную биологию для применения в эмбриологии млекопитающих. Такой междисциплинарный подход помогает докоренным образом понять, как формируются эпигенетические профили с нуля и как можно управлять экспрессией генов на уровне целой хромосомы. Дальнейшие исследования могут включать оптимизацию метода для создания синтетических хромосом больших размеров, изучение взаимодействия синтетической ДНК с другими типами клеток и тканей, а также интеграцию новых регуляторных элементов для контроля временной и пространственной экспрессии генов. Кроме того, стратегия использования изолированных ядер дрожжей как «переносчиков» ДНК в другие системы может быть адаптирована для генной терапии, биоразнообразного моделирования заболеваний и промышленной биотехнологии.
Таким образом, современные достижения в сборке и доставке мегабазовой синтетической человеческой ДНК в эмбрионы мышей не только открывают новые перспективы в фундаментальной биологии, но и прокладывают путь к будущим инновациям в области терапии генетических заболеваний и синтетической биологии человека.