Опухолевая микросреда (ОМ) представляет собой сложную экосистему, состоящую из различных типов клеток, факторов роста, сигнальных молекул и внеклеточного матрикса. Именно взаимодействие этих компонентов определяет развитие опухоли, ее агрессивность, способность метастазировать и чувствительность к различным видам терапии. В последние годы понимание роли иммунных клеток и стромы в ОМ стало ключом к продвижению онкологии, открытиям в области иммунотерапии и индивидуализации лечения пациентов. Тем не менее комплексное и системное исследование всех клеточных компонентов в пан-раковом масштабе было технически сложной задачей из-за гетерогенности данных и ограничений отдельных методов. Новые методы вычислительной биологии, особенно техники деконволюции сигнала генного экспрессирования, предлагают перспективные решения для изучения ОМ.
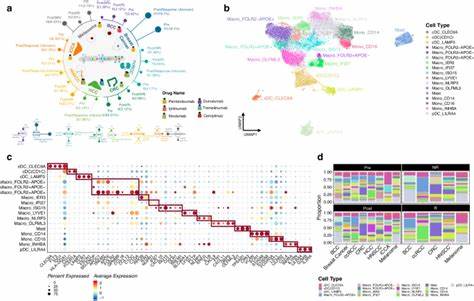
Деконволюция позволяет из «смешанной» пробы, содержащей различные типы клеток, выделить пропорции и сигнатуры отдельных клеток. Научная работа, проведенная международной группой исследователей и опубликованная в 2025 году, продемонстрировала масштабный подход к интеграции девяти известных инструментов деконволюции для оценки 79 видов клеток в более чем десяти тысячах опухолей 33 типов рака. Это позволило создать наиболее подробную карту иммунной и стромальной микросреды в рамках одного пан-ракового исследования. Ключевым новшеством стала интеграция данных разных методик, направленная на минимизацию искажений и повышения точности оценки клинически значимых компонентов ОМ. В результате сформирован единый интегрированный показатель (iScore) для каждого клеточного типа, который стандартизирует и объединяет данные из разных источников.
Это дало возможность проследить уникальные сочетания иммунных и стромальных клеток, выявить закономерности и их связь как с характеристиками опухоли, так и с ходом болезни. Анализ показал, что распределение лейкоцитов в опухолях варьируется в широком диапазоне в зависимости от типа рака и значительно влияет на прогноз пациента. Гематологические раки, такие как диффузная крупноклеточная В-клеточная лимфома, демонстрируют высокую экспрессию иммунных клеток, в то время как опухоли с иммунной привилегией, например меланома глазного дна и некоторые опухоли головного мозга, характеризуются низким уровнем лейкоцитарной инфильтрации. Интересно, что высокий уровень лейкоцитарной инфильтрации ассоциировался с улучшением выживаемости и снижением риска прогрессирования заболевания в большинстве изученных раковых типов. Исключением стали опухоли головного мозга, где богатая лейкоцитарная микросреда зачастую способствует иммуносупрессии через выделение цитокинов, что ухудшает прогноз.
Это подчёркивает важность контекста и гетерогенности в ОМ, а также необходимость разработки индивидуальных подходов к терапии. Разнообразие иммунных клеток также играет существенную роль в формировании прогностических моделей. Например, цитотоксические Т-лимфоциты (CD8+) и естественные киллеры (NK) связаны с лучшими исходами, тогда как макрофаги типа M2 и регуляторные Т-клетки (Tregs) могут способствовать прогрессированию и подавлению противоопухолевого иммунитета. В рамках исследования проведен детальный анализ подтипов рака, таких как молочная железа, где трижды негативный и HER2-положительный подтипы отличались более активной Т-клеточной инфильтрацией и, соответственно, потенциально лучшей реакцией на иммунотерапию. Не менее важен стромальный компонент ОМ, включающий фибробласты, эндотелиальные клетки и перициты, которые обеспечивают структуру и функциональную поддержку опухоли.
Накопленные данные продемонстрировали, что уровень стромы тесно связан с особенностями опухолевой архитектуры и дифференцировки. Например, в почечно-клеточном раке выявлено значительное варьирование содержания стромы между подтипами, что отражается на агрессивности и сосудистом развитии опухоли. Влияние стромальных клеток на клинический исход оказалось неоднозначным. Эндотелиальные клетки и перициты в некоторых типах рака ассоциировались с улучшением прогноза, возможно за счет нормализации сосудистого каркаса, тогда как активированные фибробласты протягивали путь прогрессированию и иммунной эвазиции. Анализ взаимодействия иммунных и стромальных компонентов показал, что комбинирование показателей CD8+ Т-клеток и стромальных индикаторов усиливает точность предсказаний риска для пациентов.
Уникальным аспектом исследования стала разработка «Карт микросреды», где на основе интегрированных показателей клеточных типов была построена кластеризация опухолей, выделяющая 41 группа с характерной иммунной и стромальной архитектурой. Эти кластеры отражают не только тип рака, но и варьируются в зависимости от степени иммунного ответа и мутационной нагрузки. При этом, в рамках подтипов рака, таких как мочевой пузырь и меланома кожи, выявлены клинически значимые подгруппы с высокой инфильтрацией Т-клеток, что связано с лучшими показателями прогрессирования. Такие данные подчеркивают важность комплексной оценки микросреды для определения чувствительности к иммунотерапии и индивидуального риска болезни. Немаловажно и то, что исследование выявило связи между мутационными профилями опухолей и микросредой.
Так, мутации в определенных драйверных генах, например CASP8, ассоциировались с повышенной лейкоцитарной инфильтрацией и возможными механизмами ухода опухоли от иммунного контроля. В то же время мутации в генах семейства RAS коррелировали с уменьшением содержания различных иммунных клеток, указывая на роль этих мутаций в создании иммуносупрессивного или иммунорефракторного микроокружения. В дополнение, мутации в FGFR3, особенно характерные для мочевого пузыря, проявляли тесную связь с подавлением иммунной инфильтрации, что может объяснять частичную неэффективность иммунных чекпоинт-ингибиторов у пациентов с такими мутациями. Данные о взаимосвязи между общей мутационной нагрузкой и уровнем иммунной инфильтрации были неоднозначными, подкрепляя观点, что Tumor Mutation Burden (TMB) не всегда является надежным прогностическим биомаркером для ответа на иммунную терапию и должен рассматриваться в контексте специфики каждого типа рака и микросреды. В целом, комплексный подход с интеграцией различных методов и инструментов анализа позволил не только получить высокоточное представление о составе и состоянии опухолевой микросреды, но и вывести практические клинические рекомендации.
Показатели iScore и выявленные иммуностромальные паттерны могут стать основанием для разработки новых диагностических и прогностических тестов, а также для выбора оптимальной терапии. Будущее исследований в этой области будет направлено на более глубокое понимание динамики изменений микросреды под воздействием терапии, а также на совершенствование методов пространственного анализа и одно-клеточной транскриптомики. Благодаря этим технологиям возможно выявление точечных мишеней и механизмов иммунного взаимодействия, что поможет преодолеть сопротивляемость опухолей и улучшить качество жизни пациентов. Таким образом, пан-раковый анализ иммунной и стромальной деконволюции открывает перспективы для точной медицины в онкологии, позволяя объединить молекулярные, клеточные и клинические данные для прогнозирования развития заболевания и выбора эффективных методов лечения.