Удлинение клеток является одним из фундаментальных процессов, обеспечивающих рост и деление бактерий. Несмотря на давнее изучение этого явления, до недавнего времени считалось, что близкородственные виды бактерий используют схожие стратегии и механизмы удлинения. Однако современные исследования, основанные на передовых методах визуализации и молекулярной биологии, показали удивительное разнообразие и пластичность этих процессов, даже среди соседних видов одной и той же семейства Caulobacteraceae. Фенотипическая пластичность в биологии обозначает способность организма проявлять различные формы фенотипа в зависимости от внутренних или внешних условий. В случае бактерий это означает, что даже при сохранении близкого генетического фона может происходить значимая вариабельность в способах роста и морфологии.
Исследование этой пластичности имеет огромное значение, поскольку механизмы удлинения клеток связаны с важными аспектами жизнедеятельности бактерий, включая устойчивость к антибиотикам, адаптацию к окружающей среде и эволюционное разнообразие форм жизни. Механизм удлинения клетки в бактериях напрямую связан с синтезом пептидогликана – основного структурного компонента клеточной стенки. Пептидогликан представляет собой сетчатую структуру, состоящую из гликозаминовых цепей, скрепленных пептидными клеточными мостиками. Этот каркас обеспечивает прочность и форму клетки, позволяя ей выдерживать внутреннее давление и при этом управлять своим ростом и делением. Синтез пептидогликана осуществляется специализированными ферментами, в первую очередь пенициллин-связывающими белками (PBP) и белками семейства SEDS, которые входят в состав белковых комплексов элонгазомы (elongasome) и дивизомы (divisome).
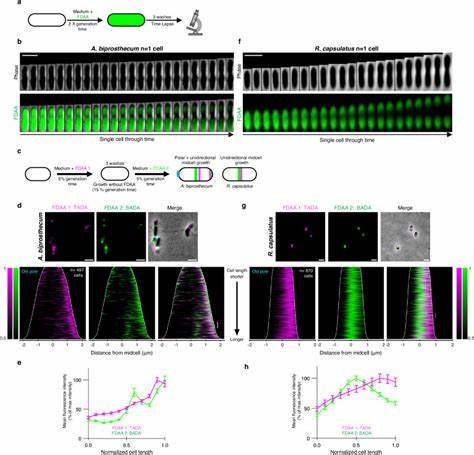
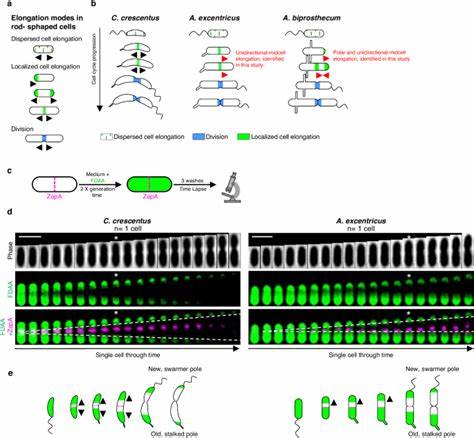
Элонагзома отвечает за добавление нового материала в боковые стенки бактерий, расширяя клетку, а дивизома концентрируется на формировании перетяжки при делении. Одним из ключевых ферментов в системе элонгазомы является класс B пенициллин-связывающий белок PBP2. Его активность и локализация играют критическую роль в направлении и режиме удлинения клетки. В наиболее изученном виде семейства – Caulobacter crescentus – PBP2 распределяется по поверхности клетки довольно равномерно, обеспечивая двунаправленное удлинение от центра к обоим полюсам. В то время как у близкородственного вида Asticcacaulis excentricus наблюдается кардинально иной режим – одностороннее удлинение от середины клетки в сторону нового полюса, при этом PBP2 концентрируется именно в области синтеза новой клеточной стенки.
Использование флуоресцентных D-аминокислот позволило исследователям детально проследить динамику пептидогликанового синтеза в реальном времени. Методика позволяла визуализировать зоны активного роста клеточной стенки с высоким пространственным разрешением. Эксперименты выявили множество новых вариантов удлинения, выходящих за рамки традиционного понимания: от дисперсного распределения синтеза по всей клеточной поверхности, полярного роста только на одном из концов клетки, до сложных комбинаций этих режимов, включая одностороннее направленное удлинение. Важным открытием стало то, что даже в пределах одного семейства Caulobacteraceae встречаются виды с существенно различающимися стратегиями роста. Помимо уже упомянутых C.
crescentus и A. excentricus, исследователи описали Asticcacaulis biprosthecum, у которого совместно реализуются полярное и одностороннее срединное удлинение. Это свидетельствует о высокой эволюционной гибкости и способности бактерий модифицировать фундаментальные процессы клеточного роста, адаптируя их под конкретные функциональные задачи или экологические ниши. Изменения локализации и активности PBP2 послужили ключевым элементом в эволюции новых стратегий удлинения. Ингибирование этого белка специфическим антибиотиком механиламином приводит к нарушению координации синтеза пептидогликана, появлению деформаций клетки и утрате односторонней направленности роста.
Таким образом, PBP2 не только катализирует необходимую химическую реакцию, но и служит своеобразным организационным центром, определяющим пространственный паттерн удлинения. Расширение анализа на другие представители альфапротеобактерий показало, что уникальные режимы роста не ограничиваются лишь семейством Caulobacteraceae. Так, Rhodobacter capsulatus, представитель другого порядка, также демонстрирует одностороннее удлинение от середины клетки, что подтверждает широкое распространение фенотипической пластичности в этой группе. Это открытие меняет парадигму, согласно которой близкородственные бактерии всегда используют одинаковые базовые механизмы роста – разнообразие оказывается гораздо шире и более динамичным. Появляется все больше данных о том, что бактерии способны гибко изменять механизмы роста под влиянием как внутренних регуляторных программ, так и внешних факторов.
Известны случаи, когда бактерии переходят от рассеянного к полярному удлинению под воздействием изменений в питательных условиях, стресса или во время определенных стадий жизненного цикла. Это свидетельствует о том, что пластичность удлинения является эволюционно выгодной чертой, позволяющей быстро адаптироваться к переменам и повышать шансы на выживание. Разнообразие механизмов клеточного роста неразрывно связано с эволюцией бактериальной формы и морфологии. У различных видов вариации в режиме удлинения чаще всего коррелируют с отличиями в форме клеток: от одиночных палочек и овальной формы до крошечных булавовидных структур с выростами и отростками. Изменения в паттернах пептидогликанового синтеза, локализации ключевых белков и активации разных элементов цитоскелета, таких как MreB и FtsZ, вместе образуют сложные регуляторные сети, определяющие окончательный внешний вид клетки.
У генетического уровня существуют консервативные белки и гены, связанные с синтезом клеточной стенки и регулирующими процесс удлинения. Однако эволюция, похоже, преимущественно действует через изменения в локализации и регуляции активности этих белков, а не через появление новых генов. В частности, отслеживаясь по изменению локализации PBP2, исследователи пришли к выводу, что подобные перестановки внутри клеточных стратификаций могут быть ключевыми шагами, генерирующими фенотипическую вариативность и новые стратегии роста. Кроме того, элементы, такие как белок DivIVA, также играют разные роли в разных линиях бактерий, регулируя полярный рост или деление. Их гибкость и адаптивность являются доказательством того, что бактерии используют эволюцию для модуляции функций существующих белков и комплексов, создавая разнообразные морфологические и функциональные варианты.
В свете последних открытий представляется, что изучение фенотипической пластичности удлинения клеток бактерий – это не просто вопрос микроэволюции, но и фундаментальная задача для понимания природы бактериального разнообразия. Она также открывает новые перспективы для разработки антибиотиков и стратегий борьбы с бактериальными инфекциями, учитывая, что разнообразие механизмов роста может влиять на эффективность терапевтических средств. Таким образом, настоящее время характеризуется сдвигом в понимании бактериального роста – от традиционных моделей к признанию широкой вариабельности и пластичности даже среди близкородственных видов. Использование современных визуализационных технологий, таких как флуоресцентное мечение D-аминокислотами, в сочетании с молекулярно-генетическими и эволюционными подходами, продолжает раскрывать новые горизонты в микробиологии, помогая глубже понять эволюцию и адаптацию микробов. Потенциал дальнейших исследований сопровождается задачами по выявлению регуляторных механизмов, контролирующих локализацию и активность ключевых белков синтеза пептидогликана, а также изучению экологических и биологических условий, приводящих к смене режимов удлинения.
Это не только поможет описать многообразие бактериальной жизни, но и внесет значительный вклад в биотехнологии, медицину и фундаментальную биологию.