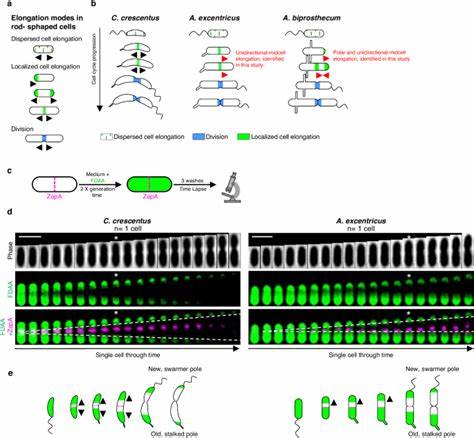
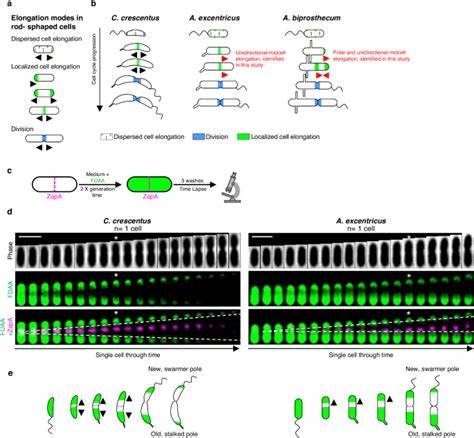
Одной из фундаментальных особенностей бактерий является их способность к росту и делению, которые обеспечиваются процессом удлинения клеток. Несмотря на давние исследования в области бактериальной морфологии, до недавнего времени считалось, что близкородственные виды бактерий обладают сходными механизмами роста. Однако последние научные данные бросают вызов этому представлению, раскрывая сложную фенотипическую пластичность, проявляющуюся в различных режимах удлинения клеток даже среди эволюционно близких видов. Такие открытия существенно расширяют наши знания о микробиологическом разнообразии и эволюционной адаптации микроорганизмов к изменяющимся экологическим условиям. Механизм удлинения бактериальной клетки основан на синтезе и ремоделировании пептидогликана – ключевого компонента клеточной стенки, придающего ей прочность и форму.
За эту функцию отвечают пенициллин-связывающие белки (PBPs) и белки семейства SEDS в комплексе с регуляторными структурами, известными как элонгазома и дивизома. Эти комплексы координируют пространственное и временное включение молекулярных компонентов, которые диктуют, где именно и как происходит рост клетки. Тем не менее, несмотря на консервативность основных компонентов, существует значительная вариабельность в их локализации и функциональной активности, что порождает различные режимы роста и, соответственно, разнообразие форм бактерий. Среди наиболее изученных моделей – род Caulobacteraceae, включающий такие виды, как Caulobacter crescentus и Asticcacaulis excentricus. C.
crescentus демонстрирует двунаправленный рост от центра клетки (midcell), когда пептидогликан синтезируется в двух направлениях от будущего делительного перетяжка. Напротив, у A. excentricus недавно обнаружен уникальный унимающий рост – односторонний от midcell к новому полю клетки. Эта особенность, выявленная с помощью флуоресцентных D-аминокислот (FDAAs), позволяет отслеживать динамику синтеза пептидогликана с высокой пространственной точностью. Применение FDAA в так называемых pulse-chase экспериментах открывает новые перспективы в микроскопическом изучении динамики роста бактерий в реальном времени.
Использование поочередного окрашивания клеток различными флуоресцентными метками позволяет визуализировать направление и локализацию активных зон синтеза клеточной стенки. Таким образом, удалось выявить вариативность в поведении даже у близкородственных видов. Например, гибридный режим, объединяющий полярное и одностороннее midcell удлинение, был обнаружен у Asticcacaulis biprosthecum, демонстрируя сложность и многообразие элонгационных стратегий. Одним из ключевых молекулярных факторов, связных с этой пластичностью, является локализация класса B пенициллин-связывающего белка PBP2. В A.
excentricus этот фермент концентрируется в одной локусе midcell, соответствующей направлению одностороннего роста, тогда как в C. crescentus он распределен более равномерно по клеточной поверхности, что согласуется с двунаправленной элонгацией. Ингибирование активности PBP2 с помощью антибиотика месиллинам приводит к нарушению координации процесса синтеза пептидогликана и формированию аномальных выпячиваний на месте активного роста, что подтверждает его центральную роль в организации пространственного направления роста. Расширение сравнительного анализа на другие представители Caulobacteraceae и даже вне этого семейства выявило, что фенотипическая пластичность элонгационных режимов не ограничена несколькими моделями. Rhodobacter capsulatus, представитель разряда Rhodobacterales, также демонстрирует одностороннее удлинение от midcell, подобное A.
excentricus. Это свидетельствует о широкой эволюционной распространённости и потенциале для разнообразных стратегий роста среди альфапротеобактерий, что требует дальнейших исследований для понимания экологических и эволюционных причин таких изменений. Пластичность механизмов роста бактерий тесно связана с их способностью адаптироваться к изменениям окружающей среды и развитию новых морфологических признаков. Например, регуляция локализации и активности PBP2 и других компонентов элонгазомы может меняться в ответ на стрессовые условия или в ходе жизненного цикла, влияя на форму и размер клетки. Сдвиги в локализационной паттерне этих ключевых белков, возможно, способствуют быстрой эволюции новых стратегий роста, обеспечивая адаптивные преимущества в морфологии и физиологии.
Фенотипическая пластичность в удлинении клеток имеет глубокие последствия для понимания эволюции бактериальной морфологии. Изменения в механизмах роста могут сопутствовать появлению новых клеточных структур, таких как трубчатые выросты (шеи) и полярные отростки, играющие важные роли в адаптации бактерий к их нишам. Такое соотношение между стратегиями роста и формой клетки подчеркивает сложность биологических процессов, формирующих морфологическое разнообразие микроорганизмов. Новые методы визуализации и молекулярные инструменты, такие как FDAA маркировка и создание флуоресцентных белковых фузий, позволяют эффективнее исследовать динамику пептидогликанового синтеза и функциональное распределение синтезирующего аппарата в клетках. Это открывает возможность системного сравнительного анализа, который позволит выявить эволюционные закономерности и пути диверсификации механизмов клеточного роста среди бактерий.
Таким образом, фенотипическая пластичность удлинения клеток у близкородственных видов бактерий отражает более широкое биологическое явление, характеризующееся модификацией и регуляцией консервативных молекулярных компонентов для достижения новых пространственных и функциональных конфигураций. Она демонстрирует, что бактерии способны использовать эволюционную гибкость для адаптации своих морфогенетических процессов в ответ на внутренние и внешние факторы. Совокупность этих открытий стимулирует дальнейшие междисциплинарные исследования, объединяющие микроскопию, молекулярную биологию, биоинформатику и эволюционную биологию. В будущем это позволит не только лучше понять принципы бактериального роста и морфогенеза, но и создавать новые стратегии борьбы с патогенными микроорганизмами, учитывая их способность менять механизмы роста и устойчивость к антибиотикам. Фенотипическая пластичность удлинения клеток – это ключ к разгадке сложного спектра бактериальных морфологий, обеспечивающих их экологическую успешность.
Ключевые белки, такие как PBP2, выступают как центральные узлы в регуляторных сетях, формирующих эти фенотипические вариации. Это исследование раскрывает новые горизонты в понимании микробной жизни и эволюционного разнообразия, демонстрируя, как избирательный отбор, мутации и регуляторные изменения воздействуют на клеточный рост и форму даже на близких эволюционных расстояниях.