Болезнь Альцгеймера — одно из самых сложных и загадочных заболеваний современности, затрагивающее миллионы людей по всему миру. Несмотря на многолетние исследования, эффективное лечение и профилактика болезни остаются серьезной проблемой для медицины. Однако недавнее открытие уникальной генетической мутации, известной как мутация Крайстчерча, способной защитить мозг от развития этой коварной патологии, прорывно меняет представления о механизмах болезни и перспективах терапии. Эта мутация влияет на ген APOE3, который кодирует аполипопротеин Е — белок, играющий ключевую роль в транспортировке холестерина и регуляции воспалительных процессов. Мутация Крайстчерча (APOE3-R136S) впервые была выявлена у женщины из Колумбийской семьи с наследственной формой раннего начала болезни Альцгеймера.
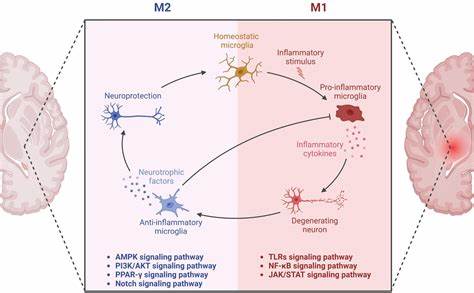
Несмотря на обширное накопление бляшек амилоида в её мозге, она сохранила когнитивные функции и демонстрировала минимальный уровень тау-белка, который считается непосредственным фактором нейродегенерации. Это удивительное наблюдение вызвало волну исследований, направленных на понимание уникальных защитных механизмов данной мутации. Группа ученых из Weill Cornell Medicine под руководством профессора Ли Ган провела серию предклинических исследований, которые пролили свет на внутренние молекулярные процессы, запускаемые мутацией Крайстчерча. Они выявили, что ключевым мишенями защитного эффекта являются клеточные пути воспаления, в частности каскад сигнальных реакций cGAS-STING, традиционно ассоциируемый с иммунной системой и ответом на вирусные инфекции. В нормальных условиях cGAS-STING активируется при обнаружении чужеродной ДНК и запускает иммунный ответ, направленный на устранение угрозы.
Однако при болезни Альцгеймера этот путь активизируется хронически, вызывая затяжное воспаление в мозгу, что усугубляет разрушение нейронов и нарушение когнитивных функций. Мутация Крайстчерча способна снижать активность этого каскада, что позволяет уменьшить воспалительный фон и тем самым замедлить развитие нейродегенеративных изменений. В экспериментах на мышах с моделью тау-патологии ученые внесли мутацию в ген APOE и обнаружили значительные улучшения в мозговой активности, снижение уровня повреждений синапсов и уменьшение накопления патологического тау-белка. Эти результаты подтверждают, что вмешательство в путь cGAS-STING может стать эффективным средством для защиты мозга от повреждений, вызванных болезнью Альцгеймера. Помимо генетического подхода, исследователи продемонстрировали, что фармакологическое блокирование cGAS-STING с помощью малых молекул имитирует защитные эффекты мутации.
Это важное открытие, поскольку прямое введение мутации в геном человека невозможно, но разработка лекарственных средств, таргетирующих этот путь, открывает реальные перспективы терапии. Такие препараты могут подавлять воспаление и восстанавливать функции мозга даже при наличии значительной патологии, связанной с тау-белком. Важным аспектом механизма воздействия мутации является воздействие на микроглию — клетки иммунной системы, локализованные в головном мозге. Микроглия играет роль «сторожевого пса», но при хроническом воспалении становится источником разрушительных процессов. Мутация Крайстчерча снижает активацию микроглии, что помогает сохранить нейроны и поддерживать нормальную функциональность мозга.
Результаты этих исследований имеют фундаментальное значение не только для болезни Альцгеймера, но и для других нейродегенеративных заболеваний, в которых воспаление мозга играет ключевую роль. Понимание того, как гены и иммунные пути взаимодействуют в патогенезе, открывает двери для создания целевого лечения, способного замедлить, остановить или даже предотвратить развитие заболеваний, лишающих качество жизни миллионов людей. Несмотря на оптимизм вызванный такими открытиями, впереди ещё предстоит много работы по адаптации этих находок к клинической практике. Необходимо провести дополнительные исследования на животных моделях других нейродегенеративных состояний, а также развивать и тестировать препараты, способные безопасно и эффективно снижать активность cGAS-STING у пациентов с заболеванием. Также важно отметить, что профессор Ли Ган, возглавляющая исследовательскую группу, участвует в создании биотехнологических компаний, направленных на трансформацию фундаментальных научных открытий в инновационные лечебные подходы.
Партнерство науки и бизнеса становится критическим фактором для ускорения внедрения новых методов в клиническую медицину. В целом, открытие справляется с одной из главных загадок в биологии болезни Альцгеймера — почему некоторые люди с высоким уровнем амилоида не проявляют значительной когнитивной деградации. Мутация Крайстчерча показывает, что влияние воспаления в мозге является решающим и что целенаправленное смягчение этого процесса может стать эффективной стратегией. Когда в будущем будут разработаны препараты, способные имитировать действие этой мутации, может открыться новая эпоха в терапии нейродегенеративных заболеваний, позволяющая сохранять память и умственные способности значительно дольше. Такое прорывное понимание биологии болезни Альцгеймера вдохновляет ученых, врачей и пациентов стремиться к более глубокому изучению механизмов мозга и поиску новых путей к здоровой старости.
Таким образом, мутация Крайстчерча — не просто редкий генетический феномен, а ключ к разгадке сложных механизмов воспаления и нейродегенерации, способный трансформировать подходы к диагностике и лечению болезней мозга. Внимание к этой мутации и связанной с ней сигнальной системе cGAS-STING обеспечит новые возможности для снижения бремени Альцгеймера и других заболеваний, основанных на воспалительных процессах в центральной нервной системе.