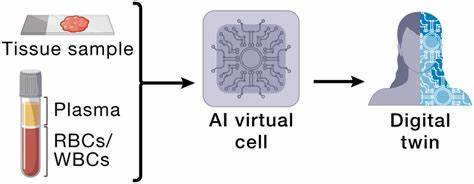
Виртуальная клетка — концепция, рожденная на стыке биологии, информатики и инженерии, представляет собой идею создания комплексной цифровой модели клетки, которая могла бы предсказывать и объяснять её поведение на молекулярном и системном уровнях. Хотя формальное определение и реализация виртуальной клетки до сих пор остаются неопределенными и спорными, идея продолжает привлекать внимание научного сообщества как одна из самых амбициозных и перспективных задач современного биологии и биотехнологий. Клетка — фундаментальная единица жизни. Именно она воплощает в себе древние принципы биохимии, информатики и химии, которые обеспечивают интеграцию множества биологических процессов: от считывания наследственной информации и синтеза белков до сложного взаимодействия с окружающей средой, адаптации и самовосстановления. Понять клетку как единое целое и суметь прогнозировать её поведение, создавая цифровые двойники, значит получить ключ к управлению живыми системами и развитию синтетической биологии.
Почему виртуальная клетка остается неуловимой? Несмотря на прогресс в молекулярной биологии, геномике и системной биологии, создание полнофункциональной модели клетки сталкивается с рядом фундаментальных сложностей. Во-первых, живые системы невероятно сложны и многогранны: в одной клетке функционируют тысячи белков, взаимодействующих в сложных сетях и регулируемых многочисленными механизмами, которые зачастую выходят за рамки генетической информации. Во-вторых, многие клеточные явления являются стохастическими, то есть подвержены случайным флуктуациям, которые влияют на конечное поведение, что затрудняет их точное моделирование. Нельзя забывать, что современная наука накапливает огромное количество данных, однако их интерпретация и интеграция в единую теорию все еще далеки от завершения. Высокопроизводительные методы секвенирования, протеомики, метаболомики и другие «омические» технологии генерируют терабайты информации, но знания о взаимодействиях, динамике и функциональных связях лишь начинают формироваться.
Одним из самых вдохновляющих примеров попыток создания виртуальной клетки является исследование механизма принятия решения вирусом фага лямбда, который, заражая бактерию, выбирает между двумя стратегиями: активным размножением с последующим разрушением клетки или интеграцией в геном хозяина в неактивном состоянии. Моделирование этого процесса с использованием стохастических уравнений показало, что этот выбор может быть обусловлен случайными молекулярными событиями, что стало значимым прорывом в понимании вирусной биологии и роли генетической стохастичности. Однако попытки масштабировать такие модели до более сложных бактерий и клеток сталкивались с серьезными препятствиями. Механистические модели, пытающиеся описать работу генетических сетей и метаболизма, часто не могли адекватно предсказывать эффекты внешних воздействий или мутаций. Причиной тому служили неполные знания, недостаточная точность параметров и невозможность учесть все многообразие клеточных процессов одновременно.
В последние годы активно развивается новая парадигма, совмещающая традиционное моделирование с экспериментальным инженерным подходом. Благодаря развитию технологий синтеза ДНК и инструментов генной редакции — CRISPR, TALE, Serine Integrases, MAGE — ученые теперь способны создавать библиотеки из миллионов клеток с разными вариациями геномных последовательностей и тестировать их в одновременных экспериментах. Это позволяет не только верифицировать гипотезы, но и выявлять новые закономерности, недоступные чисто вычислительным методам. Ключевым прорывом в этом направлении стало внедрение мультиплексных измерений при помощи методов секвенирования. Возможность связывать данные о последовательностях с количественными фенотипическими характеристиками на огромном масштабе открывает путь к созданию физической платформы для изучения эмерджентных свойств клеток.
Такой подход можно назвать экспериментальным вычислением — используя сами клетки как сотни миллионов живых моделей, ученые получают данные, на основе которых строятся и уточняются алгоритмические модели. Не менее важным фактором для успеха в области виртуальных клеток является прогресс в области искусственного интеллекта и машинного обучения. Пример алгоритмических достижений в области предсказания структуры белков, таких как AlphaFold, вдохновляет исследователей на разработку моделей, способных предсказывать не только статические характеристики, но и динамическое поведение клеточных систем. Объединение больших данных с мощными вычислительными методами обещает качественно новый уровень понимания клеточной биологии. Однако следует помнить, что метрики успеха должны выбираться разумно.
В отличие от белков, где структура напрямую связана с функцией, клеточные процессы зависят от множества факторов, многие из которых пока не поддаются количественному описанию. Сфокусированность только на предсказании экспрессии генов может не привести к пониманию таких явлений, как клеточная миграция, сенсорные реакции, межклеточные взаимодействия и адаптация к среде. Значимы также параметры, связанные с молекулярными машинами, внутриклеточными градиентами, состояниями pH, окислительно-восстановительными процессами и другими биофизическими характеристиками. Еще одна сложность заключается в необъятности и разнообразии возможных биологических состояний. Число потенциальных вариантов геномных последовательностей и конфигураций молекулярных комплексов настолько огромно, что фундаментально невозможно исследовать все варианты экспериментально или вычислительно.
Это заставляет прибегать к стратегиям оптимального дизайна экспериментов, активного обучения и вариативному моделированию для поиска наиболее информативных и перспективных направлений исследований. В итоге, виртуальная клетка перестает быть идеализированной целью полного цифрового дублирования жизни и трансформируется в платформу для интеграции знаний, инструментов и данных с целью прогнозирования и инженерного управления биологическими функциями. Это открывает огромные возможности для развития биотехнологий, создания новых препаратов, биоэнергетики, экологической инженерии и синтетической биологии. Несмотря на трудности и неопределенности, прогресс в данной области стимулирует движение вперед. Каждый новый инструмент — от методов генной инженерии до алгоритмов искусственного интеллекта — приближает науку к созданию моделей, способных разгадывать загадки клеточного поведения, контролировать их и создавать по заданным проектам.
Это не просто продолжение традиционной биологии; это зарождение новой дисциплины — инженерии живых систем, где биология выступает не только предметом изучения, но и средой для экспериментов и создания новых форм жизни. В заключение стоит подчеркнуть, что путь к виртуальной клетке — это не только вызов технического и теоретического характера. Это вопрос философии науки, характера исследований и способов познания живого. Как и в истории других великих научных открытий, успех придет через сочетание эмпирики и теории, инноваций и настойчивости, умения учиться на ошибках и непрерывного обмена знаниями между дисциплинами. Взгляд в будущее виртуальных клеток наполняет оптимизмом.
Возможно, именно новые генерации ученых и инженеров перепишут подходы к моделированию жизни и откроют двери к созданию живых систем с заданными свойствами. И тогда виртуальная клетка перестанет быть лишь концептом, превратившись в реальный инструмент, меняющий мир биомедицины, экологии и промышленности. Время покажет, насколько быстро и полно это станет возможным, но уже сегодня ясно, что эпоха виртуальных клеток — это одна из наиболее захватывающих биологических историй нашего времени.