Острый миелоидный лейкоз (ОМЛ) является сложным заболеванием крови, характеризующимся чрезмерным размножением миелоидных предшественников в костном мозге. Среди множества генетических факторов, участвующих в развитии ОМЛ, особое место занимает мутация гена NPM1 – одна из самых частых и клинически значимых. Ген NPM1 кодирует нуклеофосмин, многофункциональный белок, который играет важную роль в регуляции множества клеточных процессов. В норме он локализован в ядре и особенно в ядрышках клетки, участвуя в биогенезе рибо-сом, организации хроматина, регуляции деления клеток и поддержании структуры ядрышка. Мутации, поражающие преимущественно 12-й экзон гена, приводят к изменению структуры белка, нарушению его локализации и функциональных взаимодействий с другими молекулами.
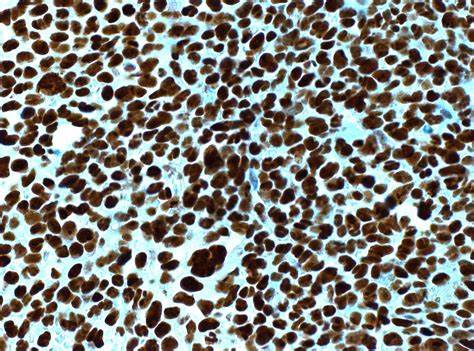
Типичная мутация в NPM1 сопровождается аномальным накоплением мутантного белка в цитоплазме клеток, тогда как нормальный вариант сохраняется в ядре, что является ключевым драйвером лейкозогенеза. Такой сдвиг локализации обусловлен потерей каталитических остатков и приобретением новых экспортных сигналов, ускоряющих выведение белка из ядра. В клиническом контексте наличие мутаций NPM1 тесно связано с рядом морфологических и фенотипических особенностей клеток ОМЛ. Чаще всего такие клетки имеют характерный «чашеобразный» вид ядра и особый профиль экспрессируемых поверхностных антигенов, что помогает в диагностике. Иммуногистохимическое определение мутантного NPM1 в цитоплазме является важным лабораторным маркером.
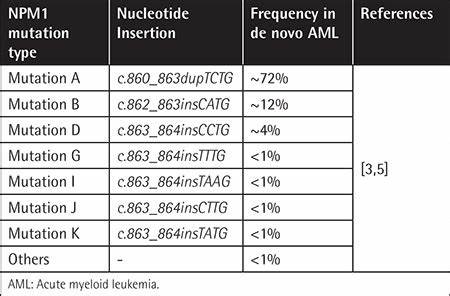
Помимо роли в патогенезе, мутации NPM1 обладают важным прогностическим значением. Они часто встречаются у взрослых пациентов с ОМЛ, составляют около 25–35% случаев, и ассоциируются с более благоприятным прогнозом, особенно при отсутствии мутации в гене FLT3 или при низком уровне последней. Международные рекомендации выделяют пациентов с мутацией NPM1 без высокоаллельной мутации FLT3 в категорию риска с благоприятным исходом, что влияет на выбор терапевтической стратегии. Благодаря этим данным, трансплантация костного мозга в первом ремиссионном периоде, как правило, не рекомендована таким пациентам из-за соотношения потенциальной пользы и риска. Что касается диагностических методов, выявление мутаций NPM1 требует высокочувствательных и быстрых тестов, так как своевременная информация влияет на лечение.
Цифровая и флуоресцентная ПЦР, фрагментный анализ с капиллярным электрофорезом, а также секвенирование нового поколения широко применяются для качественного и количественного определения мутации. Особое значение имеет оперативность возвращения результата – в идеале в пределах 24–48 часов, что максимально эффективно для начала нужной терапии. В лечении ОМЛ с мутациями NPM1 поддерживается стандартный химиотерапевтический протокол «7+3», заключающийся в комбинации цитарабина и даунорубицина. Известно, что повышение дозы даунорубицина может улучшать выживаемость пациентов с мутацией NPM1. Кроме того, появление таргетных средств расширило возможности терапии, особенно для пациентов с дополнительными генетическими изменениями.
К ингибиторам тирозинкиназ, таких как мі- достарин и гилтеритиниб, проявляется интерес при сопутствующих мутациях FLT3. Инновационные направления включают изучение селективных ингибиторов экспорта белков, направленных на коррекцию цитоплазматической локализации мутантного NPM1, а также блокаторов взаимодействия с хроматином. Важным прорывом стало использование венетоклакса – ингибитора BCL-2 – в сочетании с гипометилирующими агентами для терапии пожилых лиц с мутациями NPM1, что показало заметное снижение смертности. Мониторинг минимальной остаточной болезни (МРО) с помощью чувствительных молекулярных методов становится стандартом для оценки ответа и планирования дальнейших шагов лечения, в том числе перед трансплантацией. Возможность точного количественного определения мутантных транскриптов NPM1 позволяет своевременно выявлять рецидивы и адаптировать терапию.
Изучение механизмов влияния мутантного NPM1 на экспрессию генов HOX и коррелирующих факторов проливает свет на биологию заболевания и открывает перспективы разработки новых средств, направленных на эпигенетическую регуляцию. Кроме того, перспективной является область иммунотерапии, включая разработку CAR-T клеток, способных нацеленными атаками уничтожать лейкемические клетки с мутацией NPM1. Таким образом, ген NPM1 и его мутации занимают центральное место в понимании молекулярных основ острого миелоидного лейкоза. Современная клиническая практика опирается на молекулярную диагностику с быстрым возвращением результатов и учитывает мутационный профиль при выборе терапии и оценке прогноза. Важность исследований в этом направлении заключается в развитии персонализированной медицины и улучшении показателей выживаемости, особенно среди пожилых пациентов.
В ближайшем будущем ожидается появление новых таргетных препаратов и усовершенствованных диагностических алгоритмов, что позволит ещё более эффективно бороться с ОМЛ и адаптировать лечение под индивидуальные генетические особенности пациентов.