Острый миелоидный лейкоз (ОМЛ) с мутацией гена NPM1 занимает особое место среди гематологических заболеваний, ориентируясь на уникальные биологические механизмы и клинические характеристики. Эта форма лейкоза отличается от других форм ОМЛ благодаря специфическим генетическим изменениям, которые обуславливают патологию клеточного транспорта и нарушение регуляции роста клеток крови. В среднем примерно у трети взрослых пациентов с ОМЛ выявляется именно такая мутация, что делает ее объектом интенсивных исследований и развития специализированных методов диагностики и лечения. Ген NPM1 кодирует белок нуклеофосмин, который локализуется преимущественно в ядрышках клеток и играет ключевую роль в регуляции различных клеточных процессов, включая биогенез рибосом, ремонт ДНК и контроль циклов клеточного деления. В норме нуклеофосмин активно перемещается из ядрышка в цитоплазму и обратно, что обеспечивает его функциональность.
В случае мутации NPM1 происходит сбой в структуре белка, что приводит к его аномальной локализации в цитоплазме клетки, что является ключевым фактором патогенеза данного подтипа ОМЛ. Мутации гена NPM1, как правило, являются гетерозиготными и сконцентрированы в 12 экзоне гена, чаще всего представляя собой вставки или делеции нескольких пар оснований. Эти изменения приводят к потере специфических аминокислот в С-концевой области белка, что разрывает нормальный сигнал локализации нуклеофосмина и добавляет новые сигналы ядерного экспорта. В результате мутированный белок с большей интенсивностью экспортируется из ядрышка в цитоплазму, нарушая взаимодействие с другими клеточными белками, участвующими в регуляции апоптоза, дифференцировки и репарации ДНК. Наличие мутации NPM1 в ОМЛ выделяет этот подвид в отдельную клиническую и биологическую сущность, что было отражено в международной классификации Всемирной организации здравоохранения с 2017 года.
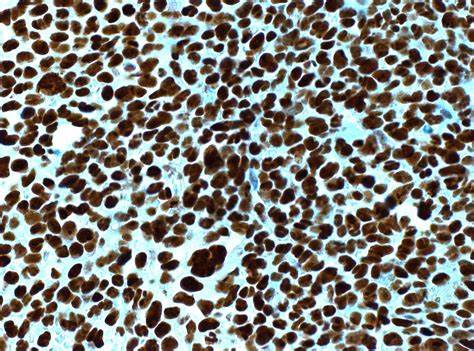
Помимо уникальных молекулярных характеристик, данная мутация ассоциируется с повышенной экспрессией генов HOXA и HOXB, отвечающих за поддержание стволовых свойств клеток и их пролиферативный потенциал. Патофизиологическая роль HOX-группы генов в лейкемогенезе дополнительно подкрепляется экспериментальными данными, подтверждающими эффект стабилизации клеточного предшественника в недифференцированном состоянии. Клинически ОМЛ с мутацией NPM1 часто диагностируется при нормальном кариотипе, что является важным диагностическим вызовом, поскольку большинство стандартных цитогенетических методов не позволяют обнаружить специфические генетические аномалии. В таких случаях важную роль играют методы молекулярной диагностики, включая иммуноцитохимию, позволяющую выявить цитоплазматическое накопление мутированного нуклеофосмина, а также методы полимеразной цепной реакции с обратной транскрипцией (РЦП), позволяющие количественно определить уровень мутантного транскрипта. Диагностика ОМЛ с мутацией NPM1 требует комплексного подхода, включающего клинико-гематологическую оценку, молекулярно-генетическое исследование, а также оценку мутаций сопутствующих генов, таких как FLT3, DNMT3A и IDH1/2.
Взаимодействие этих мутаций влияет на прогноз заболевания и определяет выбор тактики лечения. Например, сочетание мутации NPM1 с высокоаллическим индексом мутации FLT3-ITD связано с худшими исходами и часто диктует необходимость аллогенной трансплантации костного мозга. Одним из важнейших аспектов ведения пациентов с ОМЛ с мутацией NPM1 является мониторинг минимальной остаточной болезни (MRD), который помогает прогнозировать риск рецидива и оценивать эффективность терапии. Количественное определение мутантного NPM1-RNA с помощью методов реального времени PCR является примером стандарта в молекулярном мониторинге. Поддержание MRD-отрицательного статуса оказывает положительное влияние на выживаемость больных и служит показателем к продолжающейся ремиссии.
Современная терапия ОМЛ с мутацией NPM1 базируется на интенсивной химиотерапии, дополненной при необходимости таргетными препаратами. Примером является использование ингибиторов FLT3 у пациентов с соответствующей мутацией. Для пациентов с плохим прогнозом и остаточной болезнью после стандартной терапии аллогенная трансплантация стволовых клеток остается важным методом, способствующим достижению длительной ремиссии. В последние годы развивается направление, связанное с таргетированием специфических биомолекулярных процессов в ОМЛ с мутацией NPM1. Одной из перспективных мишеней служит ядерный экспорт белков, регулируемый транспортным белком XPO1 (CRM1).
Использование селективных ингибиторов ядерного экспорта, таких как селинексор и новые поколения препаратов, показывает обнадеживающие результаты в перенаправлении мутированного нуклеофосмина обратно в ядро и приостанавливает лейкемический рост. Другим важным терапевтическим направлением является вмешательство в регуляторные сети экспрессии HOX-генов с помощью ингибиторов взаимодействия менин-MLL, что приводит к дифференцировке лейкемических клеток и ингибированию их пролиферации. Эти препараты находятся на стадии клинических испытаний и уже демонстрируют значительный потенциал для улучшения исходов лечения. Иммунотерапия также приобретает значение в лечении ОМЛ с мутацией NPM1. Особенности мутантной последовательности белка нуклеофосмин делают его потенциальным антигеном для клеточно-опосредованного иммунного ответа.
Проявляется возможность разработки специфических Т-клеточных рецепторов и вакцин, направленных на уничтожение лейкемических клеток, что открывает перспективу создания высокоэффективных и селективных лечебных стратегий. Важным аспектом для клинической практики является понимание роли сопутствующих мутаций и предшествующего клонального гемопоэза, который предоставляет фон развития ОМЛ с мутацией NPM1. Персистенция предшествующих мутаций в ремиссии требует внимательного мониторинга и может потребовать дополнительных лечебных подходов для предотвращения второго лейкоза. Несмотря на значительный прогресс в понимании патогенеза и лечении ОМЛ с мутацией NPM1, остаются открытыми вопросы относительно оптимального сочетания терапевтических средств, стандартов мониторинга и профилактики рецидива. Появление новых технологий секвенирования, методик количественной оценки MRD и таргетных препаратов обещает в ближайшие годы существенно повысить эффективность терапии и выживаемость пациентов.
Таким образом, острый миелоидный лейкоз с мутацией NPM1 представляет собой отдельный биологический и клинический случай в гематологии, требующий углубленных знаний о молекулярных механизмах и интегрированного подхода к диагностике и терапии. Комбинирование классических методов с инновационными молекулярными и иммунными стратегиями формирует основу для достижения максимальных результатов в лечении этого агрессивного заболевания.