Nucleophosmin 1, или NPM1, является важным белком, задействованным во множестве клеточных процессов, особенно в клетках кроветворной системы. Ген, кодирующий этот белок, локализуется на хромосоме 5q35.1. По своим функциям NPM1 выступает в роли многофункционального регулятора, участвующего в образовании рибосом, шаперонинге гистонов, дупликации центросом, ремонте ДНК, ремоделировании хроматина и контроле путей апоптоза. Его локализация преимущественно в ядрышке с возможностью перемещения в ядро и цитоплазму позволяет ему оказывать комплексное влияние на жизненный цикл клетки.
Именно поэтому любые нарушения функции и локализации NPM1 могут привести к серьезным патологиям, включая злокачественные заболевания крови. Мутации гена NPM1 особенно тесно связаны с острым миелоидным лейкозом (ОМЛ), где выявляются примерно у 35% всех случаев заболевания и в 50-60% случаев ОМЛ с нормальным кариотипом. Данные мутации часто приводят к транслокации белка из ядрышка в цитоплазму, что является ключевым патогенетическим событием, лежащим в основе агрессивного роста и нарушения дифференцировки миелоидных клеток. Механизм мутации чаще всего затрагивает 12-й экзон гена, однако недавно выявлены и другие варианты, включая изменения в 5-м экзоне, усиливающие цитоплазматическую локализацию белка и способствующие развитию лейкемии. Морфологически мутации NPM1 связаны с формами ОМЛ, характеризующимися миеломонокитарным и моноцитарным фенотипом.
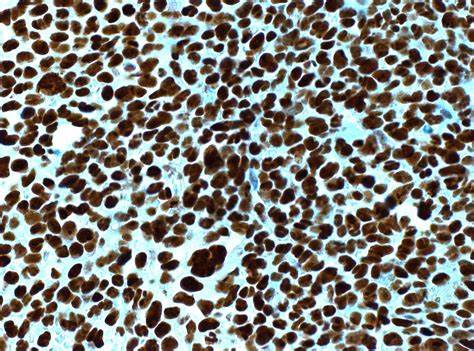
Такая связь помогает патологоанатомам ориентироваться при диагностике, поскольку иммуногистохимическое выявление NPM1 с аномальной цитоплазматической экспрессией служит надежным суррогатным маркером наличия мутации на молекулярном уровне. Это существенно ускоряет постановку диагноза и назначение адекватной терапии, а также играет важную роль в мониторинге минимальной остаточной болезни (MRD), так как мутация остаётся стабильной при рецидивах. Диагностический процесс основывается не только на морфологическом исследовании, но и на применении современных методов молекулярной биологии и иммуногистохимии. Атипичная локализация NPM1, когда обнаруживаются как ядерные, так и цитоплазматические сигналы, указывает на наличие мутации. При этом простое ядерное окрашивание свидетельствует о нормальном (диком) состоянии белка.
Важно отметить, что пока нет четкого порога по проценту клеток с цитоплазматическим окрашиванием, который мог бы однозначно предсказывать мутацию, однако сочетание данных иммуногистохимии с молекулярной экспертизой облегчает постановку точного диагноза. Помимо ОМЛ, NPM1 участвует в формировании химерных генов вследствие хромосомных транслокаций, например в t(2;5)(p23;q35), что приводит к слиянию NPM1 с геном ALK и развитию анапластической крупноклеточной лимфомы. Это расширяет клиническое значение белка и его генетических изменений далеко за рамки острой миелоидной лейкемии. Прогностически наличие мутации NPM1 в ОМЛ при нормальном кариотипе и отсутствии мутации или внутренней тандемной дупликации гена FLT3 считается фактором благоприятного прогноза. Такие пациенты демонстрируют лучшую выживаемость при стандартной терапии, что делает молекулярное тестирование обязательным для оптимизации лечения.
Кроме того, в сочетании с другими мутациями, такими как DNMT3A и IDH1/2, мутация NPM1 может влиять на динамику заболевания и определять особенности его течения. Это подчеркивает важность комплексного генетического анализа в диагностическом и терапевтическом алгоритме пациентов с миелоидными неоплазиями. В педиатрии частота мутаций NPM1 ниже, чем у взрослых, но наличие данных изменений ассоциируется с лучшими клиническими исходами, даже при одновременном выявлении других неблагоприятных генетических маркеров. У взрослых же с возрастом наблюдается тенденция к увеличению частоты мутаций, что отражает возрастные изменения в кроветворной системе и повышенную генетическую нестабильность. В повседневной практике патологов и гематологов отработка навыков идентификации аномального экспрессирования NPM1 становится критически важной.
Использование иммуногистохимии с целевыми антителами к NPM1 позволяет не только выявить маркеры мутации, но и гибко управлять тактикой наблюдения за заболеванием и оценивать ответ на терапию. Дополнительным инструментом является FISH-анализ для поиска генетических слияний, например NPM1::ALK, что улучшает дифференциальный диагноз с другими лимфопролиферативными заболеваниями. Современные исследования продолжают выяснять биологические пути, затрагиваемые NPM1, и их влияние на клеточную физиологию и онкогенез. Например, мутация стимулирует экспрессию генов HOXA и HOXB, критически важных для гемопоэза, что создает почву для лейкемогенеза. Также проведены изыскания, связывающие NPM1 с регуляцией микРНК и длинных некодирующих РНК, интегрирующих эпигенетические и генетические пути опухолеобразования.
В клинической патоморфологии использование информации о NPM1 позволяет формировать более точные отчеты о биоптатах костного мозга, указывая на наличие мутации, соответствующую иммуногистохимическую картину и молекулярное подтверждение. Это обеспечивает консистентность данных при междисциплинарном обсуждении и помогает гематологам принимать информированные решения по ведению пациента. Помимо гематопоэтических заболеваний, исследуются и другие онкологические патологии, где изменения экспрессии NPM1 имеют значение. К примеру, в гастроэнтерологии оцениваются уровни NPM1 в опухолях желудка, где некоторая гетерогенность экспрессии может быть связана с различиями в исходах и потенциальной ролью белка в карциногенезе. Таким образом, изучение NPM1 и связанных с ним мутаций является ключевым звеном в современном понимании патогенеза, диагностики и прогноза острых и хронических миелоидных заболеваний.
Интеграция данных иммуногистохимии, молекулярной генетики и клинической картины позволяет повысить точность диагностики и улучшить результаты лечения пациентов с различными гематологическими патологиями. Постоянное обновление знаний и применение передовых технологий в патологии и гематологии обеспечивают прогрессивный подход к персонализированной медицине в онкогематологии.