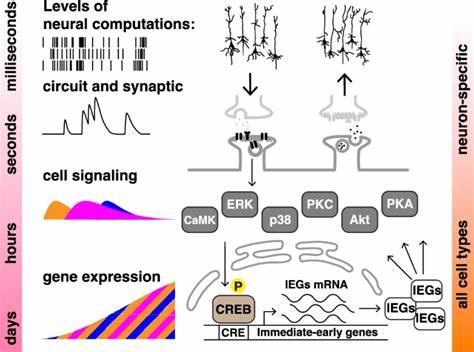
Память традиционно ассоциируется с работой нервной системы и мозговых структур, однако последние научные открытия заставляют пересмотреть это представление. Эффект интервального, или же массированного и распределённого, обучения, классически изучаемый в нейробиологии, теперь выявлен в совершенно других биологических системах — в не нейронных клетках человека. Это заявление звучит революционно и меняет наши взгляды на фундаментальные механизмы, отвечающие за формирование памяти и обучение на клеточном уровне. Основной феномен, известный как эффект массированного и распределённого обучения, был впервые описан в XIX веке Эрнстом Эббингаузом. В традиционном понимании, когда обучение растянуто во времени — то есть с интервалами между тренировками — результат запоминания оказывается гораздо устойчивее по сравнению с массированным обучением, когда вся информация «вбивается» одним блоком.
В нейронауках этот эффект объясняется сложными взаимодействиями на уровне синапсов и нейронных сетей, однако теперь обнаружено, что аналогичные процессы происходят и в клетках, не имеющих никакого отношения к нервной системе. Современные исследования, проведённые на клеточных культурах человеческих не нейронных клеток, например, в клетках нейробластомы SH-SY5Y и клетках HEK293, продемонстрировали, что при применении определённых биохимических стимулов с различным временным распределением активируется феноменология, характерная для обучения и памяти. В этих экспериментах химические вещества, такие как форсколин и тетрадеканоил фуроат (TPA), используемые для активации важных внутриклеточных сигналов, вводились в одну или несколько кратковременных импульсов с разными интервалами. В качестве «маркерной» реакции применялся уровень экспрессии люциферазы, ген, чья активность контролируется промотором, зависящим от активности трансляционного фактора CREB — ключевого регулятора в механизмах памяти на клеточном уровне. Результаты показали, что четыре распределённых импульса стимуляции с интервалом около 10-20 минут приводили к значительно более сильной и устойчивой активации CREB-зависимой транскрипции по сравнению с единичным массированным импульсом.
Такой ответ не только интенсивнее, но и длительнее сохраняется, напоминая по динамике классическую кривую забывания Эббингауза. Более того, анализ активности киназ ERK и CREB продемонстрировал, что их фосфорилирование — условие для запуска долгосрочных адаптивных изменений — было значительно выше именно после интервальных стимулов. Эти процессы ранее ассоциировались исключительно с функциям нервной системы. Важным аспектом открытия считается то, что интервал между обучающими импульсами имеет оптимальное значение. Слишком частые стимулы (массированные) либо слишком редкие (с очень длинными интервалами) приводят к менее выраженной и менее устойчивой активации генов, связанных с памятью.
Показано, что сигналы от киназ ERK и CREB интерпретируют временные паттерны стимуляции, что приводит к изменению транскрипционной активности и, впоследствии, устойчивым внутриклеточным изменениям. Значимость этих результатов нельзя переоценить. Во-первых, они подтверждают идею о том, что элементы «клеточной памяти» существуют повсеместно в биологии, а не ограничиваются мозгом и нервными клетками. Это расширяет понятие когнитивных процессов на уровне клетки, демонстрируя способность не нервных клеток оценивать, интегрировать и дифференцировать временные сигналы, что раньше казалось уникальной прерогативой нейронов. Во-вторых, модель с не нейронными клетками более удобна для изучения молекулярных и биохимических изменений, поскольку такие культуры легко масштабируемы и позволяют систематически проводить эксперименты с широко варьируемыми параметрами нагрузки и интервалов, что зачастую проблематично или практически невозможно реализовать в нейронных тканях из-за их сложности и ограниченной доступности.
Кроме того, открытие может иметь практическое значение для медицины и фармакологии. Понимание механизмов формирования клеточной памяти стимулирующих и сигнальных путей позволит способствовать разработке новых стратегий когнитивного улучшения и терапии связанных с нарушениями памяти заболеваний, таких как деменция, синдром дефицита внимания, и даже некоторых психоневрологических расстройств. Аналогично, оно поднимает вопрос о том, как распределение временных стимулов может быть оптимизировано для наиболее эффективного клеточного «обучения» в системах регенерации и клеточной терапии. Разумеется, между памятью на уровне нервной системы и клеточной памятью существуют отличия. В нейронах память формируется как результат индукции синаптической пластичности, комплексного взаимодействия нейронных цепей и паттернов электрофизиологической активности.
В не нейронных клетках пока что выявлены лишь первые уровни этой сложной молекулярной интеграции — временное преобразование повторяющихся стимулов в устойчивые изменения экспрессии генов, опосредованных CREB и ERK. Однако это открытие задаёт важные вопросы для будущих исследований. Какие другие молекулярные механизмы задействованы? Сохраняются ли аналогичные механизмы в клетках различных типов и видов? Можно ли систематически применять результаты для создания формальной математической модели клеточной памяти? Как именно регулируется обратная связь и устойчивость этих сигналов? Открыты ли дополнительные сигнальные каскады и виды посттрансляционных модификаций, влияющих на качество и продолжительность эффекта? На эти вопросы предстоит ответить посредством новых экспериментальных и компьютерных исследований. Сама концепция клеточной памяти и способности клеток формировать сигнал-ориентированное длительное поведение демонстрирует, что базовые молекулярные инструменты памяти — такие как CREB, ERK, PKA и PKC — не являются уникальными для нейронных систем, а заложены глубоко в эволюционной биологии. Весьма вероятно, что эти механизмы лежат в основе адаптивных ответов на внешние раздражители во всех клетках организма, обеспечивая таким образом единый фундамент для сложных когнитивных и физиологических процессов.
Помимо фундаментальной науки и медицины, этот прогресс стимулирует развитие биотехнологий и синтетической биологии. Встраивание и использование механизмов интервального обучения в искусственных биологических системах открывает новые возможности для динамического контроля клеточной активности, обучения живых систем на молекулярном уровне, и создания умных клеточных сенсоров. В целом, эффект массированного и распределённого обучения в не нейронных клетках человека говорит о том, что память — это не только функция специализированных тканей и органов, но и универсальная биологическая способность, встроенная в саму суть жизни. Это меняет парадигму биологии и предоставляет мощный инструмент для исследования и использования процессов обучения и памяти на самом фундаментальном уровне — уровне клетки. Для практиков и исследователей важно понять, что время между стимулами, их количество и характер запускают сложные внутриклеточные каскады, способные формировать долговременные физиологические изменения.
Новая модель помогает представить, как эти факторы можно использовать для оптимизации терапий и разработки новых подходов к лечению и улучшению когнитивных функций. Таким образом, изучение эффекта интервального обучения в не нервных клетках открывает новые горизонты понимания биологии памяти и перспективы её применения в науке и медицине.