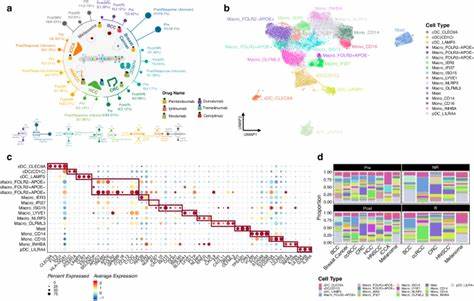
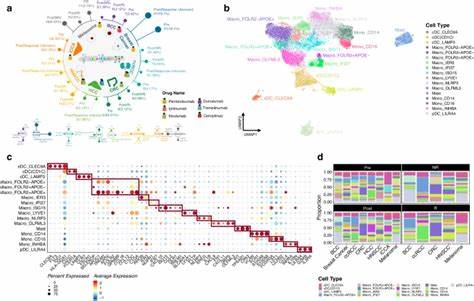
Изучение опухолевого микроокружения (ТМО) является одним из ключевых направлений современной онкологии, поскольку микросреда значительно влияет на развитие, прогрессию и терапевтический ответ опухолей. ТМО представляет собой сложную систему, состоящую из различных клеточных типов, среди которых иммунные и стромальные клетки играют центральную роль. Однако полнота и точность оценки этих компонентов долгое время оставались ограниченными из-за технических трудностей и недостаточной разрешающей способности используемых методов. Революционные достижения в области высокопроизводительного секвенирования и вычислительной биологии позволили разработать методы деконволюции, которые способны расшифровать состав ТМО на основе суммарных данных транскриптома опухолевых тканей. В недавнем крупном масштабном исследовании, охватывающем более 10 тысяч образцов из 33 типов рака, была предложена интеграция результатов девяти различных аналитических инструментов для оценки 79 типов клеток и биологических процессов ТМО.
Такой всеобъемлющий подход позволил создать наиболее детальный в истории портрет микросреды опухолей пан-ракового масштаба. Методология интегративного анализа строилась на вычислении объединенного индекса (iScore) для каждого типа клеток, который представлял собой усредненное и нормализованное значение, полученное из разных алгоритмов деконволюции. Это позволило нивелировать индивидуальные слабости каждого инструмента и минимизировать систематические ошибки. Результаты продемонстрировали высокую корреляцию с экспериментальными и независимыми количественными оценками иммунного инфильтрата, таких как фракции лейкоцитов, оцененные на основе метилирования ДНК, и количество Т-клеточных рецепторов, выявленных в РНК-секвенировании. Анализ распределения лейкоцитов по различным видам опухолей выявил значительные вариации.
Гематологические опухоли, например лимфомы и тимомы, отличались наибольшим содержанием иммунных клеток, тогда как опухоли иммунопривилегированных органов, таких как головной мозг и глаз, имели минимальный иммунный инфильтрат. Интересно, что метастазы меланомы в лимфатических узлах демонстрировали увеличенную лейкоцитарную массу, что указывает на возможность более эффективного воздействия иммунных терапий в таких локализациях. Внутренние субтипы одних и тех же видов рака также обладали разнообразным иммунным и стромальным составом. Например, подтипы рака молочной железы с положительным HER2 и базальным фенотипом отличались более высоким количеством цитотоксических Т-лимфоцитов по сравнению с люминальными подтипами. Стромальные клетки, в частности фибробласты и эндотелиальные клетки, выявили сложную противоположную роль — они могли способствовать как прогрессированию опухоли, так и снижению риска прогрессирования, в зависимости от контекста и типа рака.
Прогностическая значимость иммунного инфильтрата была подтверждена в большинстве анализируемых опухолей. Высокий уровень лейкоцитов коррелировал с улучшенной безрецидивной выживаемостью во многих группах, за исключением рака мозга, где иммунные клетки могли играть иммунодепрессивную роль. Определенные подтипы иммунных клеток, такие как цитотоксические T-клетки, естественные киллеры и B-клетки, были связаны с положительными исходами, тогда как регуляторные T-клетки и Th2-направленные T-хелперы ассоциировались с более неблагоприятным прогнозом в некоторых раках. Ключевой особенностью исследования стала картография ТМО, которая выделила 41 уникальный кластер опухолей, основанных на профилях иммунных и стромальных клеток. Эти кластеры не просто группировали опухоли по их тканевой принадлежности, но раскрывали сложные архитектонические периферии микросреды, которые влияли на прогноз и потенциальную чувствительность к терапии.
В частности, у подтипов рака мочевого пузыря и меланомы выявлены кластеры с иммунно богатым микросредой, ассоциирующиеся с лучшей безрецидивной выживаемостью, особенно в рамках определенных молекулярных субтипов, таких как люминальный и базальный сквамозный рак мочевого пузыря или рак с мутациями в RAS-генах. Анализ мутаций в драйверных генах и их связь с ТМО выявил 35 генов с значимыми ассоциациями с разными типами иммунных и стромальных клеток. Среди них CASP8 и компоненты пути RAS отличались особенно широкой корреляцией с иммунной инфильтрацией. Мутации CASP8, участвующего в пути апоптоза и иммуномодуляции, были связаны с увеличенным присутствием различных иммунных клеток, что может отражать попытки опухоли избежать иммунного надзора. В противоположность этому, мутации NRAS обычно ассоциировались с снижением уровня иммунных клеток, что указывает на их роль в формировании иммунного «выключенного» микроокружения или исключении иммунных эффекторов.
Отдельное внимание уделялось связи общей нагрузки мутаций (tumor mutation burden, TMB) с уровнем иммунного инфильтрата. Несмотря на общие предположения, TMB не всегда являлся хорошим предиктором количества иммунных клеток в опухоли. В некоторых опухолях корреляция между TMB и наличием иммунных клеток была слабой, подчеркивая сложность взаимодействия геномной нестабильности и иммунного ответа. Совокупность полученных данных предоставляет богатый ресурс для понимания сложных взаимодействий между геномными изменениями, иммунным ответом и стромальным окружением в раковом процессе. Этот всеобъемлющий пан-раковый подход демонстрирует, как многомерный анализ ТМО на основе интеграции нескольких методов позволяет не только описать гетерогенность опухолей, но и создать новые гипотезы для разработки таргетных и иммунотерапевтических стратегий.
В практическом плане результатов исследования открывают перспективы улучшения прогнозирования исходов у пациентов с раком на основе анализа иммуно-стромальной архитектуры опухоли и молекулярного профиля мутаций. Это может помочь в оптимизации выбора пациентов для иммунотерапии, а также выявлении механизмов резистентности и потенциальных биомаркеров терапевтического ответа. Таким образом, интегративный подход к деконволюции ТМО занимает ключевую позицию в современной онкологии, связывая молекулярно-генетические особенности опухоли с её микросредой. Такой подход способствует формированию персонализированной медицины и разработки новых методов лечения, учитывающих не только опухолевые клетки, но и уникальный ландшафт окружающей ткани и иммунного ответа.