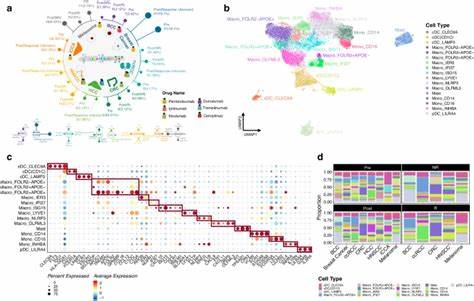
Современная онкология все чаще обращается к изучению не только самих опухолевых клеток, но и окружающей их микросреды — комплекса клеточных элементов и физиологических процессов, которые играют ключевую роль в развитии, прогрессии и ответе на лечение злокачественных новообразований. Микросреда опухоли (tumor microenvironment, TME) представляет собой сложную экосистему, в которой взаимодействуют различные виды иммунных клеток, стромальных компонентов, сосудистых структур и молекулярных сигналов. Понимание этой системы становится необходимым для разработки эффективных стратегий терапии и поиска новых биомаркеров прогноза. В этом контексте важной вехой стала масштабная пан-раковая интеграция девяти различных деконволюционных инструментов анализа транскриптомных данных, охватившая более чем 10 тысяч опухолевых образцов из 33 типов рака и позволившая детально охарактеризовать 79 типов клеток TME и связанные с ними биологические процессы. Традиционные методы анализа микросреды опухолей часто ограничиваются изучением фиксированного набора иммунных клеток, что не отражает всей сложности и гетерогенности TME.
В первую очередь, одно из главных ограничений приходится на уровень разрешения данных — например, отдельные технологии пространственной протеомики и транскриптомики или одноядерный RNA-seq (scRNA-seq) позволяют получить близкие к клеточному уровни данные, но страдают от высокой стоимости, ограниченного количества маркеров и возможных искажений из-за обработки образцов. В ответ на эти вызовы современная биоинформатика предлагает альтернативу — интегративный деконволюционный подход, который использует комплексные алгоритмы для расщепления данных генного экспрессии цельных биопсий на составные клеточные компоненты. Девять выбранных инструментов деконволюции, такие как Cibersort, MCP Counter, xCell, EPIC, TIMER, QuantiSeq, ssGSEA и новая модель на основе Sparse Group Lasso, отличаются методологиями и перечнем оцененных типов клеток. Объединение результатов каждого из них в интегрированный скор (iScore) позволило добиться более точной и воспроизводимой оценки предельного числа субпопуляций клеток в микросреде. В совокупности такие данные открывают новые горизонты понимания не только распределения иммунных и стромальных клеток в рамках опухолевой ткани, но и взаимодействий, влияющих на выживаемость и ответ на терапию.
В ходе исследования было выявлено сорок один уникальный паттерн микросреды, отражающих различия между типами опухолей и внутритиповую гетерогенность. Наиболее заметной детерминантой кластеров является количество и качество лейкоцитарной инфильтрации, которая в разных типах рака и подкласах опухолей варьирует от очень высокой в гематологических онкологиях до низкой в иммунно-привилегированных тканях, таких как глаз или мозг. Так,, например, более высокий уровень лейкоцитов ассоциируется с лучшими прогностическими показателями для большинства опухолей, тогда как в опухолях головного мозга подобное высокий инфильтрат может иметь обратный эффект из-за провоспалительных и иммуносупрессивных факторов микросреды. Подробный анализ субтипов иммунных клеток выявил сложные связи между их представлением и исходами болезни. Цитотоксические Т-лимфоциты, NK-клетки, B-клетки и определённые подмножества Т-хелперов 17-типа оказывают благотворное влияние на выживаемость пациентов, способствуя контролю опухолевого роста.
С другой стороны, регуляторные Т-клетки и Т-хелперы 2 типа, известные своим иммуносупрессивным действием, в отдельных случаях оказывают негативное влияние на прогноз. Анализ сочетаний клеточных типов и функциональных состояний микросреды (например, гипоксии) продемонстрировал, что комплексные модели взаимодействия клеток могут служить более точными предикторами прогрессирования заболевания, чем отдельные компоненты микросреды. С точки зрения стромальных компонентов, их роль в микросреде опухолей долгое время оставалась менее изученной. Тем не менее, применяя интегративный подход, исследователи выявили ключевые корреляции между содержанием эндотелиальных клеток, перицитов, фибробластов и клиническими исходами. Особое значение имеют сосудистые элементы и раковый ассоциированный фибробласт (CAF): в некоторых случаях их высокая представленность способствует сосудистому росту и прогрессу опухоли, а также влияет на адаптацию опухолевых клеток к иммунной защите.
Взаимосвязи между иммунной и стромальной составляющими указывают на то, что комплексные взаимодействия этих систем оказывают существенное влияние на опухолевый рост и отвечают за вариативность терапевтической эффективности. Создание пан-раковой карты микросреды опухолей (TME Map), основанной на 79-ти клеточных iScore, позволило выявить 41 кластер с уникальными характеристиками, преимущественно определяемыми типом опухоли и степенью иммуноинфильтрации. Эта карта дала возможность выделить клинически значимые подгруппы внутри конкретных видов рака. Например, в раке мочевого пузыря были определены две ключевые кластеры — иммунообогащенный и иммунообеднённый. Иммунообогащенный кластер, несмотря на то что охватывал множество базальных сквамозных опухолей с высокой мутационной нагрузкой, демонстрировал значительно лучший прогноз и потенциальную чувствительность к иммунотерапии, что подчеркивает важность оценки микросреды для персонализации лечения.
Аналогичные закономерности были обнаружены и для меланом с мутациями в генах RAS, где иммунообогащенный TME также ассоциировался с более благоприятным течением болезни. Связь микросреды с геномными характеристиками опухолей была дополнительно исследована на основе анализа 299 известных драйверных генов. Итегрированное изучение мутаций и iScore выявило 35 генов, мутации в которых ассоциировались с изменениями состава как иммунных, так и стромальных клеток. К примеру, мутации в гене CASP8 связывались с увеличением разнообразия иммунных клеток, что может отражать сложный механизм «ухода» опухоли от иммунного надзора. В то же время мутации в генах RAS и FGFR3 чаще всего коррелировали с иммунным исключением, что подтверждает их роль в создании иммуносупрессивной среды и резистентности к терапии.
Интригующим оказалось обнаружение генотип-иммунофенотипических связей, которая подчеркивает необходимость комплексного подхода в изучении опухолевых биологических систем. Значительным открытием стало установление того, что мутационная нагрузка опухолей (tumor mutation burden, TMB), часто рассматриваемая как потенциальный биомаркер иммунной терапии, не показывает однозначной корреляции с уровнем иммунной инфильтрации и может проявлять вариабельность в зависимости от типа рака. Это означит, что TMB не всегда выступает в роли универсального предсказателя ответа на иммунотерапию, что требует поиска более точных и интегративных биомаркеров. Методологически важной составляющей исследования стала разработка и внедрение математической модели Sparse Group Lasso, которая позволила справиться с проблемами коллинеарности и точнее оценить вклад различных клеточных популяций в общий профиль микросреды. Перекрестное объединение и стандартизация данных администраций девяти алгоритмов повысили надежность и воспроизводимость полученных результатов, что послужило для углубленного и широкомасштабного пан-ракового анализа.
В совокупности полученные данные представляют собой ценнейший ресурс для онкологов, иммунологов и исследователей, стремящихся раскрыть детальную архитектуру микросреды опухолей и связать ее с клиническими исходами и генетической базой. Открытия подчеркивают, что TME является динамичной и уникальной для каждого конкретного типа рака экосистемой. Идентификация особенностей иммунной стромальной архитектуры дает шанс на создание более точных моделей прогнозирования, которые учитывают сложные взаимовлияния между клеточными типами и мутационными альтерациями. Также продемонстрирована большая значимость использования интегративных подходов с применением множества деконволюционных алгоритмов для повышения качества оценки клеточного состава и функционального состояния опухолей, что ранее было невозможно при использовании единственных методов. В практическом плане данный подход открывает возможности для улучшения персонализации терапевтических решений, в том числе назначения иммунотерапевтических препаратов, ориентированных на конкретные характеристики микросреды и геномные особенности опухолей.
Резюмируя, изучение пан-ракового микросредового ландшафта с помощью интегрированной деконволюции расширяет наше понимание биологии опухолей и механизмов их прогрессии. Такой подход способствует выявлению новых биомаркеров и потенциальных терапевтических мишеней, что обеспечивает перспективы улучшения исходов для пациентов с разнообразными онкологическими заболеваниями.