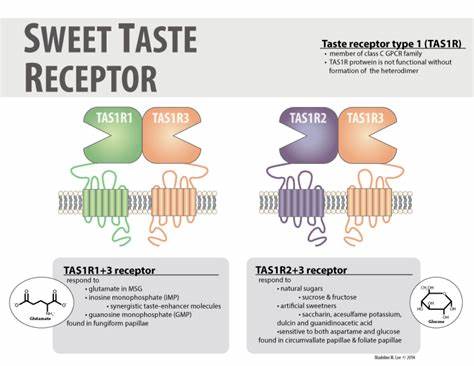
Восприятие сладкого вкуса является важным элементом человеческих пищевых предпочтений, напрямую влияя на выбор рациона и состояние метаболического здоровья. Сладость привлекает к потреблению пищи, при этом рецепторы, отвечающие за ощущение сладкого, не только обрабатывают вкусовую информацию, но и участвуют в регуляции энергетического обмена и метаболических реакций организма. Основным сенсором сладкого вкуса у человека является рецептор класса C, представляющий собой гетеродимер из двух субъединиц — TAS1R2 и TAS1R3. Каждая из этих субъединиц играет уникальную роль в распознавании разнообразных сладких веществ, включая как натуральные сахара, так и искусственные подсластители, а также сладкие белки. Длительное отсутствие строго физических моделей взаимодействия этих белков ограничивало понимание их молекулярного механизма функционирования.
Недавние исследования с использованием передовых методов криоэлектронной микроскопии позволили получить первые трехмерные реконструкции деконволюционного комплекса рецептора TAS1R2-TAS1R3, как в его свободном (апо) состоянии, так и связанном с широко используемым подсластителем сукралозой. Эти данные стали важным прорывом в раскрытии архитектуры данного рецептора и механизмов его активации. Структурные данные показали, что TAS1R2 и TAS1R3 образуют асимметричный гетеродимер, где связывание сукралозы происходит исключительно в так называемой «венериной ловушке» (venus flytrap domain) субъединицы TAS1R2. Эта доминантная роль TAS1R2 в детекции сладких веществ указывает на высокую специфичность и разнообразие путей распознавания, обеспечиваемых этим белком. Состояние связанного лиганда практически изменяет конформацию рецептора, что инициализирует передачу сигнала внутрь клетки.
Эксперименты с мутагенезом ключевых аминокислот в области связывания позволили определить конкретные остатки, ответственные за контакт с различными типами сладких веществ, что подтверждается молекулярными динамическими симуляциями. Это понимание дает основу для проектирования новых подсластителей, которые могут избирательно и эффективно активировать рецептор, снижая побочные эффекты и улучшая вкусовые качества. Особенно перспективно использование этих знаний для создания низкокалорийных и безопасных заменителей сахара. Структурное сравнение каталитически активных состояний рецептора с апо-формой выявило особые конформационные переходы, характерные для класса C GPCR-рецепторов. Эти изменения позволяют понять уникальную цепь событий, от связывания лиганда до активации внутриклеточных сигнальных путей, что является важным аспектом тканевой и системной регуляции вкусового восприятия и метаболизма.
Функциональные тесты в культурах клеток на основе измерений внутриклеточного уровня кальция подтвердили биологическую активность различных форм рецептора и мутантных вариантов. Кроме того, были изучены реакции рецептора на широкий спектр сладких веществ: от обычных моно- и дисахаридов до искусственных подсластителей и сладких белков, что подчеркивает его функциональную гибкость и адаптивность. Интересно отметить, что роль рецептора сладкого вкуса выходит за пределы ротовой полости. Исследования последних лет показывают его участие в регуляции уровня глюкозы, секреции инсулина и даже пищевого поведения через мозговые центры. Рецептор экспрессируется в эпителии кишечника и поджелудочной железе, влияя на метаболические сигналы и помогая организму более эффективно реагировать на потребление сахара.
Достигнутые структурные открытия открывают новые перспективы для фармакологического вмешательства. Возможность создания модулей и антагонистов рецептора может помочь в борьбе с метаболическими заболеваниями, такими как диабет второго типа и ожирение, где контролируемое восприятие сладкого и потребление сахара имеют решающее значение. Современные методы прогнозирования структур белков, включая AlphaFold 3, дополнительно подтвердили экспериментальные данные и расширили понимание интерфейсов взаимодействия между субъединицами рецептора и другими сигнальными молекулами. Эти модели помогают планировать дальнейшие исследования и ускоряют процесс разработки новых соединений для регуляции вкуса. Стоит также отметить, что различные популяционные вариации в генах TAS1R2 и TAS1R3 связаны с индивидуальными особенностями вкусовых предпочтений и чувствительности к сладкому.
Исследования в области генетики питания указывают на потенциальную персонализацию диет с учетом генетического профиля человека, что может существенно влиять на профилактику и лечение заболеваний, связанных с питанием. Влияние сладкого вкуса на человеческий организм довольно комплексно. Помимо основных функций распознавания вкуса, рецептор откликается на множество структурно различных молекул, что позволяет человеку воспринимать широкий спектр сладких вкусовых оттенков. Это открывает широкие возможности для создания новых подсластителей с улучшенными вкусовыми качествами, безопасностью и функциями, поддерживающими здоровый образ жизни. Обобщая, можно отметить, что фундаментальное понимание структуры и функций человеческого рецептора сладкого вкуса TAS1R2-TAS1R3, подкрепленное новыми экспериментальными данными и компьютерным моделированием, является важным этапом в науке о вкусе.
Эти знания не только улучшают понимание биохимических и физиологических механизмов вкусового восприятия, но и задают направление для практического применения в пищевой индустрии, медицине и диетологии. Перспективы использования результатов исследования включают разработку новых поколений подсластителей, улучшение качества жизни людей с метаболическими нарушениями и углубленное изучение роли вкусовых рецепторов в различных органах и тканях. Дальнейшие исследования этой области обещают раскрыть дополнительные функции рецептора, его связи с другими системами организма и возможности для целенаправленной модуляции вкусовых ощущений и метаболических процессов. Сочетание структурной биологии, молекулярной физиологии и биоинформатики становится мощным инструментом для понимания сложнейших процессов восприятия вкуса и их значимости для здоровья человека.




![Making electronic dance music in 1990 with budget home computer [video]](/images/98038877-B5F1-4973-BBCE-E0DBC91F8F3E)

