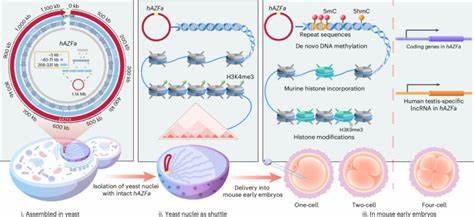
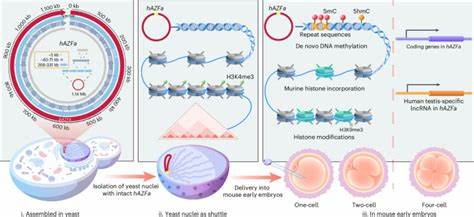
Современная биотехнология и геномика переживают этап стремительного развития, благодаря которому стало возможным синтезировать и собирать целые мегабазные участки человеческой ДНК. Впервые разработанный метод SynNICE позволяет осуществлять не только точную дез ново сборку мегабазных последовательностей, но и их доставку в ранние эмбрионы мышей, что является беспрецедентным шагом в изучении эпигенетического регулирования и транскрипции на самом базовом уровне. Такие нововведения открывают перед учеными перспективу моделирования человеческой геномной регуляции на живых эмбриональных системах других видов, позволяя изучить процессы и механизмы, ранее недоступные для прямого наблюдения. Дез ново сборка – это процесс синтетического создания длинных последовательностей ДНК из коротких химически синтезированных фрагментов. Традиционные методы сборки и поддержания больших фрагментов страдали от ограничений стабильности и точности, особенно в случае повторяющихся и регуляторных последовательностей, представленных в сотнях килобаз или мегабаз.
Особую сложность представляет сборка многомегабазных регионов человеческой ДНК, поскольку они содержат значительные повторяющиеся элементы, эндогенные ретровирусные вставки и многочисленные некодирующие регуляторные последовательности. Для таких задач классические системы на основе бактериальных искусственных хромосом (BAC) или эцшерихий кишечника (E. coli) оказываются недостаточно надежными и эффективными, а выделение готовых больших фрагментов сопряжено с потерями и повреждениями ДНК. В данной методике применили дрожжевой организм Saccharomyces cerevisiae как хозяина для рекомбинационной сборки более одного мегабаза последовательностей человеческой ДНК. Дрожжи способны эффективно осуществлять гомологическую рекомбинацию и удерживать большие сегменты ДНК посредством специализированных систем.
В частности, свежий подход предполагает минимизацию несоответствий за счет комбинаторной стратегии, при которой сначала собираются мелкие синтезированные фрагменты в более крупные сегменты, а затем происходит последовательная конкатенация в еще более крупные конструкции. Такой геномный инжиниринг позволил успешно сформировать 1.14-мегабазные участки, соответствующие локусу AZFa, расположенному на мужской Y-хромосоме человека. Этот регион известен своей высокой плотностью повторяющихся элементов, достигающей более 69%, и значим для изучения мужской фертильности. Одним из ключевых вызовов стала целостность и стабильность мегабазной конструкции в клетках хозяина, а также сохранение ее хроматиновой организации.
Исследования показали, что вставленные синтетические фрагменты ДНК не оказывали значительного негативного влияния на рост дрожжей или их транскрипционный и протеомный профили. Более того, аналоги эпигенетических меток и 3D-структуры хроматина частично сохранялись, что указывает на успешную интеграцию и относительную стабильность синтетического хромосомного региона. Следующим этапом стало выделение и доставка этих мегабазных ДНК-сегментов в млекопитающих клетки с сохранением их структурной и функциональной целостности. Здесь было разработано инновационное решение – метод NICE (Nucleus Isolation for Chromosomes Extraction), позволяющий выделять ядра дрожжевых клеток с целыми, неразрушенными хромосомами внутри, без применения химического фиксирования, что в свою очередь минимизирует повреждения ДНК. Выделение ядер сопровождалось использованием ингибиторов нуклеаз и агентов, способствующих поддержанию компактного состояния хроматина.
Полученные изолированные ядра сохраняли свою структуру длительное время при минусовых температурах, что значительно упрощало их использование. Для доставки клеточных ядер в ретрансплантируемые эмбрионы мышей была применена микроманипуляция – микроинъекция в зрелые яйцеклетки. В процессе наблюдалось спонтанное внедрение гистонов мыши в синтетический дрожжевой хроматин, что подтверждает динамичное ремоделирование нуклеосом и своеобразное «почти мгновенное» начало адаптации синтетической ДНК к хроматиновым условиям животного организма. Особое значение имела активация процессов де-ново метилирования ДНК – наличия 5-метилцитозина и 5-гидроксиметилцитозина, которые возникают именно во время развития эмбриона и играют ключевую роль в подавлении или активации генных регионов. Анализ транскрипционных данных с последовательной оценкой на различных этапах развития эмбрионов мыши выявил характерные моменты активации человеческих генов из синтетической AZFa области, начало которой совпадает со стадией четырехклеточного эмбриона, когда в норме происходит геномная активация у мышей.
Это указывает, что трансгенные мегабазные последовательности подвергаются временной регуляции со стороны эмбриональной среды и задействуют схожие эпигенетические механизмы, как и натуральные геномные регионы. Важно подчеркнуть, что активация и регуляция генов осуществлялась в отсутствие традиционных наследственных эпигенетических маркеров дрожжевого организма, что демонстрирует самостоятельное формирование эпигенетического ландшафта млекопитающих на базе полностью синтетической и «наивной» ДНК. Поведение синтетической ДНК оказалось не случайным, а последовательностно-зависимым, с высоким уровнем метилирования, связанным преимущественно с повторяющимися элементами и интергенными регионами. Этот феномен аналогичен наблюдаемым паттернам реметилирования в естественных эмбрионах, что подтверждает биологическую правдоподобность модели. Данные технологии открывают новые возможности для фундаментальных исследований механизмов формирования и изменения эпигенетических состояний у высших организмов.
Ранее изучение этих процессов было затруднено тем, что природные хромосомы унаследованы с уже существующими модификациями, которые трудно полностью «стереть» или модифицировать. Методика SynNICE и применение микродоставки мегабазной синтетической ДНК в эмбрионы позволяют наблюдать процесс установления эпигенетических меток с нуля, обеспечивая беспрецедентное понимание геномной регуляции и порядка запуска экспрессии генов на ранних этапах развития. Кроме того, способность создавать и доставлять большие и сложные геномные конструкции обеспечивает платформу для будущих биоинженерных приложений – от создания человеческих хромосомных конструкций и моделей заболеваний до разработки новых терапевтических подходов на уровне геномного редактирования. Важным аспектом является то, что дрожжевая система и метод NICE позволяют минимизировать повреждения и метилирование, связанные с бактериальными технологиями, что обеспечивает большую чистоту и функциональность изготавливаемых конструкций. Перспективы развития включают конструирование синтетических человеческих хромосом, которые могут быть введены не только в мышиные, но и в другие млекопитающие системы, для создания универсальных моделей и тестирования генетических гипотез.
Важным направлением является доработка систем доставки и репликации таких конструкций в организмах-хозяевах, а также интеграция с технологиями редактирования и анализа мультиомных данных. Таким образом, метод дез ново сборки и доставки синтетической мегабазной человеческой ДНК в мышиные эмбрионы является значительным научным прорывом, который меняет подходы к исследованию геномной и эпигеномной регуляции. Совмещение химического синтеза, дрожжевой рекомбинации, изоляции ядер и эмбриональной микродоставки открывает перед современными исследователями уникальные возможности для изучения фундаментальных биологических процессов и создания новых биотехнологических инструментов, приближающих нас к искусственному пониманию и контролю жизни на уровне генома.