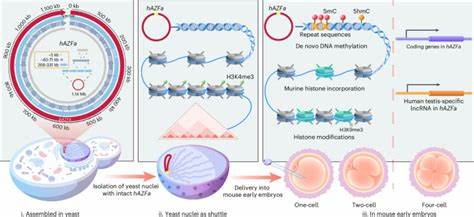
В последние десятилетия геномика и биотехнологии сделали гигантский шаг вперёд, приблизившись к возможности прямого управления геномом млекопитающих на масштабах, ранее считавшихся экспериментально недостижимыми. Одним из самых амбициозных вызовов является полное понимание и воспроизведение эпигенетических механизмов, лежащих в основе регуляции генов и развития живых организмов. На этом фоне выдающееся достижение – метод SynNICE, разработанный международной командой исследователей, который удачно решает проблему сборки и доставки мегабазных фрагментов синтетической человеческой ДНК непосредственно в ранние эмбрионы мышей. Эта инновационная технология открывает перспективы для детального изучения механизмов де-ново эпигенетических меток и транскрипционной активности на реконструированных фрагментах ДНК, полностью лишённых наследуемых эпигенетических изменений природы. SynNICE (Synthetic Nucleus Isolation for Chromosome Extraction) сочетает в себе передовые подходы химического синтеза, молекулярной биологии и клеточной инженерии, что позволило впервые собрать человеческий фрагмент ДНК длиной более миллиона нуклеотидов (1,14 Мб), охватывающий регион AZFa – область, связанная с мужским бесплодием.
Эта область на Y-хромосоме содержит как кодирующие, так и некодирующие регуляторные последовательности, что важно для изучения взаимодействия генов и эпигеномных факторов на уровне, который невозможно достичь классическими методами. Прежде чем синтезировать такую длину последовательности, учёные столкнулись с серьёзными техническими преградами. Традиционные методы сборки больших секторов ДНК, например, с использованием бактериальных искусственных хромосом (BAC), ограничены в стабильности при размерах порядка 500 килобаз. Помимо этого, выделение и трансфер крупных фрагментов могут сопровождаться деградацией ДНК и потерей структурных особенностей, что особенно важно для ретропозиций, повторов и регуляторных элементов. Спецификой метода стало использование дрожжевых клеток Saccharomyces cerevisiae, способных рекомбинировать отдельные химически синтезированные короткие олигонуклеотидные фрагменты в более длинные конструкции с последующей сборкой в мегабазный участок с уникальной повторяющейся структурой.
Дрожжевая система обладает рядом преимуществ: высокая точность гомологической рекомбинации, устойчивость ингредиентов и возможность многократных циклов сборки. Для снижения числа ошибок и улучшения эффективности собрали 233 фрагмента по 5,5 килобаз, последовательно трансформируя и рекомбинируя их в серии более крупных сегментов – SynA, SynB, SynG и SynC. Дополнительное применение технологии CRISPR-Cas9 позволило объединить эти части в один мегабазный фрагмент, обеспечив при этом точность конкатенации и минимизацию ошибок. Полномасштабная проверка путем пульсирующего электрофореза в геле и глубокого секвенирования подтвердила успешную сборку и структурную целостность полученного синтетического участка. Уникальным этапом стала разработка способа изоляции структурно сохранённых ядер дрожжевых клеток, несущих собранную синтетическую хромосому.
Технология NICE включает бережное выделение ядер без использования кросслинкинга, что предотвращает деградацию и нарушение трехмерной структуры ДНК. За счёт применения ингибиторов ДНКаз, а также стабилизаторов конденсации хроматина, удалось сохранить нативное состояние синтетической ДНК, покрытой дрожжевыми гистонами, обеспечив высокую сохранность и возможность её транспорта в эмбриональные клетки. Доставка синтетической мегабазной ДНК непосредственно в метафазные яйцеклетки мышей осуществлялась при помощи микроманипуляции путем инъекции изолированных ядер дрожжей. Введение такого крупного хроматинового фрагмента позволило исследовать процессы ремоделирования хроматина в живой клетке, проследить взаимодействие с хистонными белками мыши и оценить динамику внесения эпигенетических отметок, и, что чрезвычайно важно, ДНК в исходном синтетическом виде была полностью лишена эпигенетических меток, что позволило наблюдать процесс их первичной постановки (де-ново) в эмбриональной среде. Результаты показали, что уже на одноклеточной стадии после доставки происходит спонтанное замещение дрожжевых гистонов на гистоны мыши с последующей эмбеддированной модификацией, включая метилирование ДНК и гидроксиметилирование.
Такой паттерн локализации 5-метилцитозина преимущественно приходится на повтаряющиеся элементы генома, в частности, на межгенные и интронные области, что свидетельствует о направленной установке эпигенетических сигналов, а не случайном или неспецифическом процессе. При этом характерные для гетерохроматина метки гистонов, такие как H3K9me3, практически не регистрировались, что указывает на уникальные механизмы эпигенетической регуляции в данном случае. По мере развития эмбриона началась регуляция транскрипционной активности синтетического региона. В частности, гены DDX3Y, UTY и долгнекодирующий РНК TTTY15, расположенные в области AZFa, начали экспрессироваться на ранних стадиях – с четырёхклеточного эмбриона. Этот порядок и временная точность экспрессии согласуются с природной моделью развития человеческой Y-хромосомы, при этом отмечено влияние динамики метилирования ДНК на регуляцию транскрипции.
Применение специфических ингибиторов, блокирующих активность DNA метилтрансфераз или ферментов TET, продемонстрировало подтверждение ключевой роли установленной метиляции в контроле экспрессии генного участка. Технология SynNICE не только позволяет детально изучать фундаментальные биологические процессы, но и служит платформой для написания синтетических геномов, пригодных для функциональных исследований и потенциальных терапевтических применений. Возможность обратной сборки Mb-масштабных, полностью редактируемых фрагментов и их доставка в живые клетки млекопитающих открывает перспективы создания искусственных человеческих хромосом для исправления генетических заболеваний и глубокого анализа эпигенетической регуляции. Дальнейшие усовершенствования методики нацелены на совершенствование стабильности и репликации синтетического материала в клетках млекопитающих, включая использование векторных систем человеческих искусственных хромосом (HAC). Помимо этого, улучшение методов доставки и микроманипуляции позволит расширить диапазон клеточных моделей, увеличивая возможности трансляции технологии для регенеративной медицины и биоинженерии.