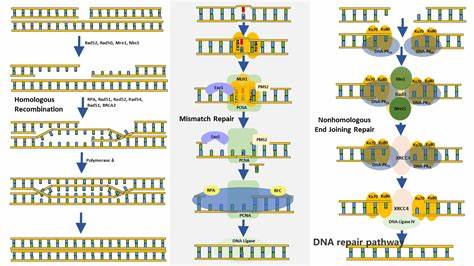
Наш организм постоянно подвергается воздействию различных факторов, которые могут повредить молекулу ДНК – носителя генетической информации. Ультрафиолетовое излучение, химические вещества, а также ошибки при копировании ДНК во время деления клеток – все это способствует возникновению повреждений. Однако природа позаботилась, чтобы клетки не только быстро устраняли дефекты в генетическом коде, но и знали, когда стоит прекратить процесс ремонта. Это защитный механизм, который предотвращает как недоделанный, так и чрезмерный ремонт, предотвращая потенциальные опасности для организма. Недавнее исследование, проводившееся на дрожжах и человеческих клетках, проливает свет на этот тонко настроенный контрольный механизм в ответе на повреждения ДНК.
Ранее считалось, что когда в клетке возникает повреждение ДНК, запускается каскад событий по активации множества белков, которые инициируют восстановление. Ключевым этапом в этом процессе является синтез белков, необходимых для ремонта, при котором рибосомы считывают сообщения с мРНК – носителя информации от ДНК к месту синтеза белков. Однако теперь стало ясно, что клетки регулируют не только старт этого процесса, но и умеют замедлять или приостанавливать сборку ремонтных белков в зависимости от текущих потребностей, не допуская их перепроизводства. Исследование выявило участие двух специфических белков – «стражей клетки», которые выполняют роль своеобразных светофоров, переключающихся с разрешающего сигнала «зелёный» на предупредительный «красный». Когда угроза для ДНК ликвидируется, они снижают скорость чтения мРНК и тем самым уменьшают синтез белков, задействованных в ремонте.
Такой подход позволяет клетке сохранять баланс между эффективностью ремонта и экономией ресурсов, а также снижает риск накопления вредных мутаций, которые могут возникать при чрезмерной активности ремонтных систем. Биологическая необходимость такой регуляции обусловлена потенциальной опасностью как недоремонта, так и сверхремонта. Недостаточная починка повреждений может привести к мутациям, нарушению работы клеток и развитию заболеваний, в том числе рака. С другой стороны, слишком активный механизм восстановления способен привести к перенагрузке клеточного аппарата, образованию ошибок при чрезмерном вмешательстве в структуру ДНК, а также к излишнему расходу энергии, что негативно сказывается на клеточном метаболизме и общем состоянии организма. Использование дрожжей в исследовании не случайно: эти одноклеточные организмы часто служат моделью для изучения фундаментальных биологических процессов, поскольку многие из них сходны с механизмами в человеческих клетках.
Опираясь на наблюдения в дрожжах и подтверждая результаты на клетках человеческой кожи, учёные дали более цельное представление о том, как именно работает внутриклеточная система контроля за ремонтом генома. Отдельное значение имеет понимание того, что регуляция синтеза ремонтных белков происходит на уровне транслокации – процесса, когда рибосомы считывают мРНК. Это подчеркивает, насколько многоступенчатым и тонким является контроль над восстановлением ДНК. Традиционные взгляды концентрировались на активации тех или иных белков непосредственно после повреждения, но новая информация говорит о том, что клетка проводит масштабные изменения именно на уровне производства механизмов ремонта, адаптируя их количество и активность к реальным потребностям. Важным аспектом этой регуляции является её временной характер.
Клетки не просто останавливают или замедляют синтез ремонтных белков, а делают это временно, чтобы после устранения повреждений процесс мог возобновиться при необходимости. Такой динамичный контроль обеспечивает клетке возможность быстро реагировать на новые повреждения, сохраняя при этом эффективность и безопасность генетического материала. Открытие, сделанное учеными, имеет большое практическое значение. Понимание механизмов, которые предотвращают как неправильный, так и чрезмерный ремонт ДНК, может стать основой для новых методов лечения заболеваний, вызванных мутациями и нарушениями в репарации генома. К примеру, в онкологии эти знания помогут разрабатывать стратегии, направленные на управление способностью раковых клеток восстанавливаться, повышая эффективность терапии и снижая риск развития резистентности к лекарствам.
Кроме того, регулирование синтеза ремонтных белков на уровне мРНК может найти применение в биотехнологиях и фармацевтике, где контроль экспрессии генов имеет огромное значение. Разработка лекарств, способных имитировать или усиливать функцию «стражей» – регуляторов ремонта, может открыть новые горизонты в профилактике и лечении болезней, связанных с генетическим повреждением. Современные методы молекулярной биологии и генетики, включая секвенирование РНК и протеомный анализ, позволили выявить и подробно описать эти ранее скрытые механизмы. Исследования подтверждают, что клетка не только чрезвычайно быстро реагирует на угрозы, но и тщательно регулирует все свои процессы, избегая избыточной траты ресурсов и поддерживая целостность своего генетического кода. В целом, новая информация служит напоминанием о величии и сложной природе жизни на клеточном уровне.
Каждая клетка – это миниатюрная лаборатория, способная не только исправлять ошибки, но и контролировать свои действия с большой точностью. Понимание этих процессов углубляет наши знания о биологии и открывает перспективы для инновационных медицинских подходов, направленных на поддержание здоровья и борьбу с болезнями на самом фундаментальном уровне.