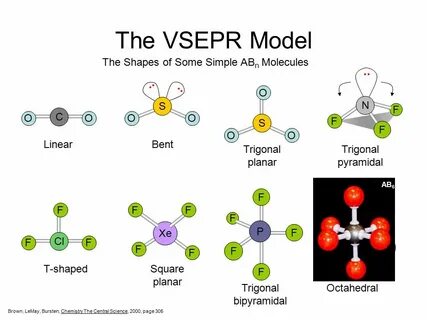
В современном мире химии одно из наиболее значимых достижений в понимании пространственной структуры молекул – это VSEPR-модель, или модель отталкивания электронных пар в валентной оболочке (от английского Valence Shell Electron Pair Repulsion). Эта модель помогает ученым и студентам предсказывать форму молекул на основе взаимодействия между их электронными парами. В данной статье мы подробно рассмотрим, как работает эта модель, ее применение, а также её ограничения. Основы VSEPR-модели VSEPR-модель была предложена в 1950-х годах канадскими химиками Рональдом Гиллеспи и Рональдом Нахолмом. Суть модели заключается в том, что пары валентных электронов, находящихся в валентной оболочке атома, стремятся быть как можно дальше друг от друга из-за электростатического отталкивания.
Это означает, что формы молекул определяются распределением этих электронных пар вокруг центрального атома. Модель применяется к молекулам определённого типа, часто обозначаемым как ABnEm, где A – центральный атом, B – атомы, связанные с центральным атомом, а E – свободные электронные пары. Например, в молекуле воды (H2O) центральный атом кислорода связан с двумя атомами водорода, но также имеет две свободные электронные пары. Эти свободные пары занимают пространство и влияют на форму молекулы, делая её угловой. Геометрия молекул и электронные пары Согласно VSEPR-модели, геометрия молекул может быть предсказана на основе количества связывающих и свободных электронных пар.
Для начала разберём наиболее простые случаи: 1. Если у центрального атома две связывающие пары электронов, молекула имеет линейную форму (например, BeCl2), с углом 180°. 2. Три связывающие пары приводят к трigonальной плоскостной форме (например, BF3) с углом 120°. 3.
Четыре пары дают тетраедрическую форму (например, CH4) с углом 109,5°. 4. С пятью парами мы получаем тригонально-бипирамидальную структуру (например, PCl5) с углами 120° и 90°. 5. Если же у нас шесть электронных пар, молекула будет иметь октедрическую форму (например, SF6) с углом 90°.
Однако не все молекулы имеют идеальные формы. Свободные электронные пары требуют больше пространства, чем связывающие пары, что приводит к искажениям углов. В молекуле воды, например, угол H-O-H составляет около 104,5°, что меньше, чем в идеальной тетраэдрической форме. Примеры применения VSEPR-модели Одним из ярких примеров применения VSEPR-модели является молекула аммиака (NH3). Здесь центральный атом азота связан с тремя атомами водорода и имеет одну свободную электронную пару.
Это приводит к тому, что молекула принимает трigonально-пирамидальную форму. Угол H-N-H равен примерно 107°, что меньше ожидаемого тетраэдрического угла из-за отталкивания свободной пары. Другими примерами являются молекулы углекислого газа (CO2) и сероводорода (H2S). У CO2 линейная структура и угол 180°, тогда как у H2S молекула имеет угол 92° из-за наличия свободных электронных пар на сере. Ограничения VSEPR-модели Несмотря на свою простоту и удобство, VSEPR-модель имеет свои ограничения.
Она не всегда справляется с объяснением геометрии более сложных молекул, особенно тех, которые содержат переходные металлы. Эти элементы подвержены различным типам спинового взаимодействия и могут иметь неожиданную геометрию. Также VSEPR-модель не учитывает влияние изменений в электроотрицательности атомов, что может влиять на углы и формы молекул. Например, в некоторых случаях отличаются значения углов между слоями из-за присутствия полярных связей. Будущее VSEPR-модели Несмотря на ограничения, VSEPR-модель остается важным инструментом в химии.
Она предоставляет базовый уровень понимания для студентов и исследователей, позволяя предсказывать формы молекул до углубленного изучения их электронной структуры с использованием более сложных теорий, таких как теории молекулярных орбиталей. Современные программные обеспечения для химического моделирования часто используют VSEPR как первый шаг для построения молекул, прежде чем переходить к более точным расчетам. Это показывает, что, несмотря на свои недостатки, VSEPR-модель играет важную роль в химических исследованиях и образовании. Заключение VSEPR-модель – это мощный инструмент, который прост в использовании и предоставляет ключ к пониманию молекулярной геометрии. Она основана на простом, но глубоком принципе – отталкивании электронных пар, что позволяет в доступной форме познакомить с основами молекулярной химии.
Важно помнить, что, как и любая модель, VSEPR имеет свои ограничения, и для более сложных систем необходимо прибегать к более сложным методам и теориям.