Мелкоклеточный рак легкого (МРЛ) является одной из наиболее агрессивных форм онкологических заболеваний дыхательной системы. Его характеризует стремительное размножение клеток, раннее метастазирование, высокая скорость рецидивов и, увы, низкая выживаемость пациентов. Традиционные методы лечения, включая химиотерапию с применением цисплатина и этопозида, а также иммунотерапию, обеспечивают временный эффект, после чего заболевание вновь прогрессирует. В свете этих обстоятельств поиск новых терапевтических целей и более глубокое понимание механизмов развития МРЛ имеют критическое значение для улучшения прогноза пациентов. Одним из новаторских направлений в исследовании МРЛ стала область изучения взаимодействия раковых клеток с нервной системой.
Ранее было доказано, что периферические нервы оказывают влияние на прогрессию ряда опухолей, однако формирование функциональных синапсов между нейронами и злокачественными клетками внекостномозгового происхождения оставалось под вопросом. Эксперименты, проведенные группой исследователей во главе с Вигнешом Сактхивелу и коллегами, впервые продемонстрировали наличие таких синапсов между нейронами и клетками мелкоклеточного рака легкого. Научная группа использовала инновационный подход - вставочную мутагенезную скрининг-систему с транспозоном piggyBac в модели мышей с условной инактивацией генов Rb1 и Trp53, что является классической моделью репликации МРЛ. Этот метод позволил выявить генетические элементы, ассоциированные с образованием и функционированием синапсов, среди которых оказались ключевые регуляторы глутаматергической передачи, такие как гены NRXN1, NLGN1, DCC и RELN. Параллельный анализ генетических данных пациентов с МРЛ подтвердил значительную мутационную нагрузку именно в этих синаптических генах, что указывает на их потенциальную роль в патогенезе заболевания.
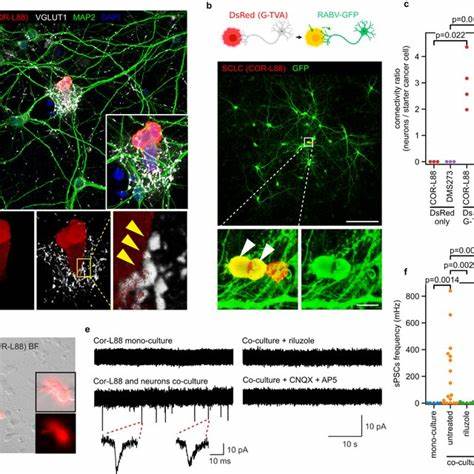
Экспрессия синаптических генов и белков была выявлена не только на уровне ДНК, но и в транскриптомах опухолевых клеток мышей и человека. При помощи методов секвенирования одиночных ядер (snRNA-seq) и клеток (scRNA-seq) аккумуляция нейронально-связанных мРНК оказалась характерной именно для злокачественных клеток, подтверждая, что данные феномены являются чертой самой опухоли, а не окружающей ткани. Это подтвердило предположение, что МРЛ сохраняет черты, присущие пульмональным нейроэндокринным клеткам - начальной клетки происхождения МРЛ. Дальнейшие исследования с использованием конфокальной, STED и экспансионной микроскопии позволили визуализировать прямые контакты между нейронами и раковыми клетками. На данных участках выявлялась ко-локализация пресинаптических маркеров, таких как VGluT1, и постсинаптических белков, в частности HOMER1, что указывает на формирование структур, морфологически сходных с типичными синапсами.
Ультраструктурные данные, полученные с помощью корреляционной световой и электронной микроскопии, подтвердили существование синапсов, где в пресинаптической части, прилегающей к раковым клеткам, находился запас везикул, а также просвет синаптической щели, что является характерным признаком функциональной синаптической передачи. Функциональность таких синаптических контактов была подтверждена с помощью электрофизиологических исследований. При совместном культивировании клеток МРЛ и нейронов происходила генерация спонтанных постсинаптических токов (sPSCs), которые были чувствительны к блокаторам натриевых каналов, NMDA- и AMPA-рецепторов, а также ингибиторам высвобождения глутамата, таких как тетродотоксин, D-AP5, CNQX и рилузол. Это указывает на то, что раковые клетки способны принимать глутаматергические синаптические сигналы от нейронов. Кроме того, для некоторых клеток МРЛ также была выявлена чувствительность к блокаторам GABA_A рецепторов, что свидетельствует о наличии комплексных видов синаптической коммуникации, включающей и ингибирующую нейротрансмиссию.
Дополнительно было проведено ретроградное клTracing with rabies virus experiments demonstrated that SCLC cells receiving synaptic inputs are monosynaptically connected to excitatory and inhibitory neurons, confirming the existence of functional synapses not only in vitro but also in vivo within brain allografts. Данные о функциональной связи между нервными клетками и опухолевыми клетками имеют не только фундаментальное, но и важное клиническое значение. В частности, эксперименты показали, что клеточная пролиферация МРЛ существенно повышалась при совместной культивации с нейронами, что было частично предотвращено блокированием нейрональной активности тетродотоксином, что говорит о значимом воздействии нейронных синапсов на рост опухоли. С учётом выявленных механизмов передачи глутаматергических сигналов, внимание исследователей было обращено на возможность использования антиглутаматергических препаратов в терапии МРЛ. В ряде экспериментов были протестированы два соединения: (S)-3,4-дикарбоксипенилглицин (DCPG), селективный агонист метаботропного глутаматного рецептора GRM8, и рилузол - FDA одобренный ингибитор высвобождения глутамата.
Лечение этими препаратами в модельных мышах с МРЛ привело к замедлению роста опухолей, улучшению выживаемости и показало потенциал для комбинирования с базисной химиотерапией, особенно в случае применения рилузола. Проведённые исследования открыли новую перспективу в лечении мелкоклеточного рака легкого, где терапия не только направлена на уничтожение непосредственно раковых клеток, но и на нарушение их взаимодействия с нервной системой, которое способствует их агрессивному росту и прогрессии заболевания. Формирование настоящих синапсов между нейронами и МРЛ является уникальным механизмом, который ранее не был описан для опухолей внекостномозгового происхождения. Таким образом, мелкоклеточный рак легкого демонстрирует фенотип, характерный для нейроэндокринных клеток, включая способность формировать и использовать синаптическую передачу для поддержки своей пролиферации. Данное открытие кардинально расширяет понимание биологии МРЛ, усиливая важность изучения нейрон-опухолевых взаимодействий как существенного фактора опухолевого микросреды.
В ближайшем будущем появление новых препаратов, нацеленных на блокирование нейрональной передачи сигналов или дестабилизацию нейроопухолевых синапсов, может привести к значительным прорывам в терапии заболевания. Кроме того, исследование синаптических механизмов способно расширить представления о склонности различного рода раков к метастазированию в нервную систему и поведению опухолей. В заключение, синергия нейробиологии и онкологии помогла раскрыть ранее неизвестные особенности мелкоклеточного рака легкого. Открытие функциональных синапсов между нейронами и раковыми клетками стимулирует разработку инновационных подходов к клиническому лечению, открывая дверь к более точным, персонализированным и эффективным методам борьбы с этим смертельным заболеванием. .