Эффект интервального повторения или массированного и распределённого обучения — одна из ключевых особенностей процесса запоминания и усвоения информации. Известный в нейронауках как явление, при котором распределённое во времени обучение превосходит по эффективности концентрированное в один момент, этот эффект был подробно описан в работе Германа Эббингауза в конце XIX века и с тех пор остаётся предметом активных исследований. Однако до недавнего времени данное явление рассматривалось исключительно в контексте нейронных систем — мозга и нервной ткани, где сложные сети взаимодействующих нейронов опосредуют обучение и память. Новаторские научные данные сегодня простирают границы этого восприятия и подтверждают, что эффект интервального повторения проявляется и на уровне отдельных, ненейронных клеток человека. Это открытие кардинально меняет наше понимание того, каким образом клетки в организме способны адаптироваться к внешним сигналам и хранить информацию о прошлых событиях.
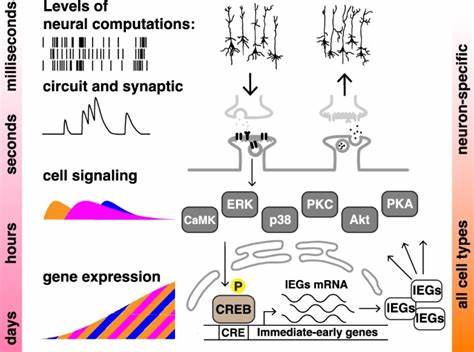
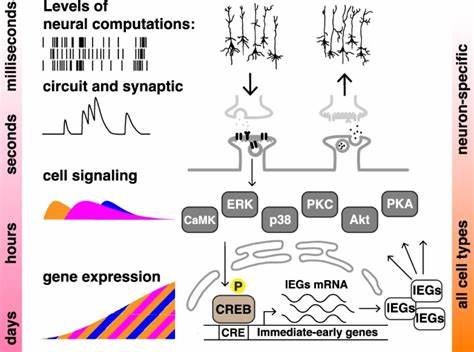
Новое исследование, проведённое группой учёных из Нью-Йоркского университета, продемонстрировало механизм, избирательно реагирующий на временную структуру сигналов внутри двух линий стабильно трансфицированных человеческих клеток, не имеющих нейронной природы. В основу экспериментов была положена модель активации внутриклеточных сигнальных каскадов с помощью классических физиологических агонистов — форсколина и тетрадионилафорбола ацетата (TPA). Активируя различные киназные пути, данное вмешательство позволило эмитировать процессы, аналогичные обучающим стимулам. В качестве биомаркера «клеточной памяти» исследователи использовали экспрессию люциферазы, контролируемой промотором, зависимым от фактора транскрипции CREB (cAMP response element-binding protein). Интенсивность и длительность сигнала люциферазы отражала степень активации CRE-зависимой транскрипции, что в нейрональных системах напрямую связано с формированием долговременной памяти.
Интересно, что применение четырёх небольших импульсных доз активации, разнесённых с интервалом в 10–20 минут, приводило к значительно более сильному и устойчивому ответу по сравнению с единичным длительным воздействием той же суммарной дозировки, называемым массированным обучением. Это чёткое свидетельство наличия эффекта интервального повторения в ненейронных клетках, где отсутствует синаптическая передача и нервная архитектура. Аналогично нейронным системам, хронотип временных интервалов между стимулами имел решающее значение: слишком длинные интервалы снижали эффективность, а оптимальные — усиливали и продлевали CREB-зависимую активацию. Так, клетки буквально «запоминали» временной ритм сигналов, активируя ключевые молекулярные компоненты памяти, такие как ERK (extracellular signal-regulated kinase) и CREB, с характерной пространственно-временной динамикой. На уровне молекулярных механизмов разница между массированным и распределённым обучением проявлялась в степени фосфорилирования ERK и CREB, что напрямую влияло на индуцированную транскрипцию.
Фосфорилированный ERK быстро перемещался в ядро, где модифицировал активность транскрипционных факторов, стимулируя долгосрочные изменения генетической активности. Интересно, что при блокировке активности ERK или CREB с помощью высокоизбирательных ингибиторов эффект интервального повторения исчезал, что подтверждало их критическую роль в реализации памяти на клеточном уровне. Таким образом, данный эффект индуцируется не только интенсивностью воздействия, но и временем между ними, что указывает на сложное интегрирование временных сигналов сигнальными каскадами. Уникальное экспериментальное решение состояло в использовании клеточных линий SH-SY5Y и HEK293, которые не являются нейронами, но стабильно экспрессируют люциферазу, реагирующую на сигналы CREB. Это позволило не только ещё раз проверить гипотезу о наличии «клеточной памяти» вне нервной системы, но и расширить её на разные типы клеток, подтверждая универсальность и консерватизм этих биохимических процессов.
Показанные результаты открывают перспективы изучения когниции и памяти как фундаментальных клеточных явлений, выходящих за рамки традиционных представлений о мозге. В основе таких явлений лежат сложные биохимические сети, включающие киназы PKA, PKC, ERK, а также другие регуляторные молекулы. Протекание сигнала через них напоминает вычислительные процессы, где временные и амплитудные параметры имеют решающее значение. Именно здесь скрывается фундаментальная идея «клеточной когниции» — способность клеток интегрировать сведения о предшествующем опыте и модифицировать своё поведение и ответ на будущее воздействие. Изучение забывания на клеточном уровне было также поддержано выявленными различиями в скорости затухания люциферазной активности в ответ на массированные и распределённые стимула.
Отметим, что данный подход значительно упрощает получение экспериментальных данных по сравнению с традиционной нейробиологией, так как не требует использования первичных нейрональных культур или животных моделей с их спецификой и ограничениями. Высокая воспроизводимость и возможность масштабирования экспериментов на негетерогенных клеточных линиях приостанавливают прецедент новой парадигмы в изучении памяти. В перспективе это позволяет создавать математические модели памяти, выявлять новые таргеты для фармакологического вмешательства и разрабатывать подходы к когнитивному улучшению и лечению расстройств, связанных с нарушениями памяти. Новое понимание способности сигнализации CREB и ERK в ненейронных клетках к учету временной структуры информации меняет традиционное представление о том, что память функционирует исключительно в пределах нервной системы. Оно подтверждает, что многие молекулярные механизмы, лежащие в основе памяти, являются консервативными и могут использоваться различными типами клеток для адаптивного поведения.
По сути, память оказывается фундаментальным биологическим явлением, встроенным в динамику клеточных сигнальных каскадов. Распределённый во времени стимул стимулирует более высокий уровень CRE-зависимой люциферазы и поддерживает её активность длительное время после окончания воздействия, тогда как массированное воздействие вызывает менее устойчивый ответ. Такой профиль соответствует классическим представлениям о формировании долговременной памяти, при которой не только усиление текущего отклика, но и замедление забывания — важная характеристика успешного сохранения информации. Стоит обратить внимание, что исследования выявили различия между PKA и PKC в отношении чувствительности к параметрам стимуляции: PKA более реагировал на длительность воздействия, а PKC — на число повторений сигналов. Это может отражать дифференцированную роль этих киназ в разных аспектах клеточной памяти и открывает вопрос об их интегративной кооперации в многоуровневом контроле.
Безусловно, данные открытия только приоткрывают завесу над мультифункциональным потенциалом клеток за пределами нервной системы. Ответы, подобные обнаруженным, могут иметь большое значение для понимания адаптивных реакций в иммунной системе, эндокринологии, и клеточной биологии развития и регенерации тканей. Более того, концепция клеточной памяти и эффекта интервального повторения может быть применена для оптимизации терапевтических протоколов, например, в разработке лекарств и вакцин, где важна чувствительность клеток к временной структуре стимулов. В целом, эффект интервального повторения, наблюдаемый во внеклеточных линиях человека, подтверждает, что память не является исключительно функцией мозга, а фундаментальной характеристикой жизни на клеточном уровне. Это приближает нас к пониманию универсальных принципов биологической информации и её хранения, расширяя горизонты нейробиологии, молекулярной биологии и медицины.
Дальнейшие исследовательские усилия в изучении взаимосвязей молекулярных компонентов, математическом моделировании и междисциплинарном анализе обещают новые качественные прорывы в науке о памяти и обучении.