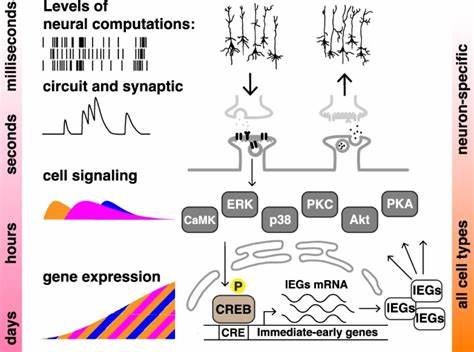
Изучение процессов памяти и обучения традиционно сосредоточено на нервной системе, где нейроны взаимодействуют в сложных сетях, формируя различные формы когнитивной активности. Однако современная наука открывает всё новые и новые горизонты, показывая, что динамика обучения и память могут проявляться и в клетках, не относящихся к нервной ткани. Одним из таких значимых феноменов является эффект распределённого обучения, или эффект пространственного повторения, который долгое время считался исключительно нейронным явлением. Новейшие исследования демонстрируют, что этот эффект также наблюдается в немнейронных человеческих клетках, что бросает вызов привычным представлениям о клеточной памяти и её биохимических основах. Эффект распределённого обучения представляет собой феномен, когда обучение, разбитое на несколько сеансов с определённым интервалом времени, приводит к более устойчивому и сильному запоминанию по сравнению с однократным, массированным обучением.
Во многих животных этот эффект подтверждён на поведенческом и нейрофизиологическом уровнях, а его механизмы рассматриваются как ключевые для формирования долговременной памяти. Впрочем, до недавнего времени считалось, что подобная функциональная динамика напрямую связана с наличием нейронных цепей и синаптической пластичностью. Новый подход, применённый в исследовании с использованием немнейронных клеточных линий, показывает, что даже одиночные человеческие клетки, лишённые нервного происхождения, способны «распознавать» временные паттерны стимуляции и трансформировать их в длительные изменения в активности определённых генов. Для моделирования «обучения» в клетках ученые использовали повторяющиеся кратковременные воздействия химических стимуляторов, активирующих ключевые внутриклеточные сигнальные пути, такие как PKA и PKC, которые широко распространены в множестве типов клеток. Для отслеживания последствий этих воздействий применялась биомаркерная система с использованием короткоживущего лусциферазного репортера, регулируемого промотором, чувствительным к CREB – важному транскрипционному фактору, участвующему в процессах памяти.
Эксперименты подтвердили, что четыре разнесённых по времени (спейсированных) кратковременных воздействия вызывали более мощную и устойчивую активацию транскрипционной активности по сравнению с одним длительным «массированным» воздействием, несмотря на одинаковую суммарную интенсивность стимуляции. Эта реакция сопровождалась усиленной и более продолжительной фосфорилизацией ключевых молекулярных посредников, таких как ERK и CREB, которые, как известно, играют критическую роль в формировании и сохранении долговременной памяти. При этом ингибирование ERK или CREB полностью блокировало данное преимущество интервального обучения, доказывая функциональную значимость этих сигнальных компонентов. Подобные результаты наблюдались как в клетках нейробластомы человека, так и в гетерогенных эмбриональных клетках почки, что демонстрирует общие, консервативные механизмы сигнальных каскадов, связывающих временную динамику стимуляции с генетическими реакциями. Это говорится о том, что маркеры и механизмы, традиционно ассоциируемые с нейронной памятью, по сути, базируются на фундаментальных биохимических процессах, которые могут развиваться и проявляться за пределами нервной системы.
Дискуссия наследует представление о «клеточном познании» – способности клеток фиксировать, интерпретировать и запоминать сигналы из окружающей среды, трансформируя эти данные в долгосрочные изменения функций. Это расширяет наше понимание когнитивных процессов за пределы мозга и нейронных сетей, предоставляя новую призму для исследования взаимосвязи между архитектурой клеточных систем и обучением. Создание таких модельных систем с высокой воспроизводимостью и масштабируемостью даёт немалые преимущества для фундаментальных исследований. К примеру, в нейронных культурах сложно контролировать и многократно повторять точные временные паттерны стимуляции без искажений, тогда как немнейронные культуры позволяют добиться высокого ступеня контроля и автоматизации экспериментов. Таким образом, изучение эффекта распределённого обучения в немнейронных клетках способно ускорить разработку формальных математических моделей молекулярных основ памяти, потенциально открывая новые пути для когнитивного улучшения и терапии нейродегенеративных заболеваний.
На молекулярном уровне устойчивость памяти связана с рядом механизмов. Одним из них является сохранение активности ключевых киназ за счёт различных положительных обратных связей и устойчивых форм ферментов, таких как конститутивно активный PKMζ. Кроме того, CREB регулирует широкий спектр генов, ответственных за пластичность и адаптацию, а также может быть активирован и поддержан через несколько независимых путей, включая циклы транскрипции и стабилизации транскрипционных комплексных структур. Этот масштабный биохимический комплекс обеспечивает не только первоначальное кодирование сигнала, но и его устойчивое сохранение или «запоминание» на длительный период. Уникальная особенность использованной в экспериментах системы — использование лусциферазы с PEST-секвенцией, обеспечивающей быстроту деградации белка.
Это позволяет отслеживать не накопление продукта, а именно активный и устойчивый транскрипционный отклик, что более точно отражает динамику памяти и процессы забывания. Замечено, что величина разницы между массированным и распределённым обучением заметно увеличивается с течением времени, отражая классическую кривую забывания, исследованную Эббингаузом в XIX веке. Рассмотрение различных промежутков между последовательными импульсами стимуляции выявило существование оптимальных временных интервалов (от 10 до 20 минут), при которых эффект распределённого обучения достигает максимума. Интересно, что разные сигнальные пути, такие как PKA и PKC, оказываются «настроены» на разные временные шкалы, что предполагает сложное взаимодействие между ними и возможное перекрывание их функций при действии нейромедиаторов. В перспективе изучение этих биохимических механизмов в немнейронных клетках может повлиять не только на базисное понимание памяти, но и на разработку новых методов оптимизации обучения, лечения когнитивных нарушений и нейродегенеративных заболеваний.
Автоматизация и масштабируемость таких моделей сделают возможным тонкий анализ влияния временных закономерностей стимуляции, генетических мутаций или фармакологических вмешательств на процессы памяти. Таким образом, эффект распределённого, или пространственного, обучения в немнейронных клетках — это не просто экспериментальное открытие, а фундаментальное свидетельство того, что память и обучение — универсальные биологические процессы, укоренённые на молекулярном уровне. Их проявление в клетках разных типов подчеркивает важность кинетики сигналов и интегративной роли транскрипционных факторов в формировании устойчивых клеточных состояний. Это расширяет границы науки о памяти, демонстрируя, что ее основные принципы выходят за рамки нервных систем и действуют на уровне отдельной клетки, обеспечивая гибкость и адаптивность организма в целом.