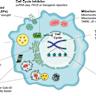
Клеточное старение — это фундаментальный биологический процесс, при котором клетки теряют способность делиться и переходят в устойчивое состояние остановки клеточного цикла. Этот феномен играет важную роль в поддержании гомеостаза тканей, а также является ответом организма на разнообразные стрессовые факторы, такие как повреждение ДНК, окислительный стресс и укорочение теломер. Несмотря на то, что клеточное старение задумано природой как защитный механизм, предупреждающий размножение повреждённых или потенциально опасных клеток, оно также связано с рядом патологических состояний и возрастными нарушениями. Исследования последних лет значительно углубили наше понимание биологии клеточного старения, выявили его молекулярные основы и механизмы регуляции, открывая новые перспективы для терапии разных заболеваний, включая онкологию, фиброз и нейродегенеративные патологии. Основным биологическим признаком клеточного старения является стойкая остановка клеточного цикла.
Такая остановка обусловлена активацией различных сигналов, возникающих в ответ на хронический стресс. Ключевыми триггерами являются повреждения ДНК, связанные с неблагоприятными внешними и внутренними факторами, укорочение теломер по мере многократных делений, а также повышенный уровень реактивных форм кислорода (ROS). При активации повреждений ДНК запускается каскад сложных сигнальных путей — так называемый ответ на повреждение ДНК (DDR). Он активирует белок p53, который в свою очередь способствует экспрессии ингибитора циклин-зависимых киназ p21 (CDKN1A). Этот ингибитор препятствует формированию комплексов циклинов с CDK, необходимых для прогрессии клеточного цикла через фазы G1 и S.
Одновременно с этим увеличивается экспрессия и других CDK-ингибиторов, таких как p16INK4a (CDKN2A), который взаимодействует с CDK4 и CDK6, также блокируя клеточный цикл. Нестабильность генома и накопление повреждений в ДНК являются драйверами старения клеток и служат в качестве барьера против развития онкологических заболеваний. При нормальных условиях клеточное старение ограничивает пролиферацию повреждённых клеток, тем самым предотвращая превращение их в злокачественные образования. Однако парадоксально, что в уже сформированных злокачественных тканях сенесцентные клетки способны выделять широкий спектр биологически активных молекул, известных как фенотип секретируемого старения (SASP). SASP включает в себя цитокины, хемокины, протеазы, факторы роста и иммуномодуляторы, которые могут создавать иммунопривилегированную среду, способствующую росту и распространению опухолей, а также устойчивости к лекарственным препаратам.
Клеточное старение не ограничивается только защитной ролью. В физиологии оно играет ключевую роль во многих процессах, таких как развитие тканей, заживление ран, ремоделирование и эмбриогенез. За счёт выделения SASP-факторов сенесцентные клетки могут активировать и привлекать макрофаги, фибробласты и прогениторные клетки, способствуя регенерации тканей. Со временем же, по мере накопления таких клеток, их влияние становится патогенетическим, что приводит к развитию хронических воспалительных состояний и возрастных заболеваний. В последние годы особое внимание уделяется роли клеточного старения в патогенезе идиопатического лёгочного фиброза (IPF) — тяжелого заболевания легких, связанного с интерстициальным фиброзом.
Доказано, что старение и накопление повреждений ДНК в альвеолярных эпителиальных клетках способствует прогрессированию данной болезни. Одним из ключевых регуляторов этого процесса является белок YTHDC1, который участвует в процессе репарации ДНК. Ученые показали, что снижение уровня YTHDC1 сопровождается усилением клеточного старения и прогрессированием фиброза, в то время как его повышенная экспрессия способствует активации комплекса Mre11–TopBP1–ATR, что усиливает репарацию повреждений и тормозит старение клеток. Эта находка открывает перспективу для разработки таргетированных терапий, направленных на усиление репаративных механизмов и предотвращение функционального истощения тканей. Другим важным аспектом, связанным с клеточным старением, является дисфункция митохондрий и лизосом.
Митохондрии играют центральную роль в энергетическом метаболизме и контроле уровня ROS, а лизосомы обеспечивают деградацию поврежденных органелл и макромолекул. Дисбаланс в функционировании этих органелл приводит к усилению окислительного стресса и дальнейшему повреждению клеток. Транскрипционный фактор EB (TFEB) выступает как главный регулятор биогенеза и функционального состояния митохондрий и лизосом. Его активация способствует экспрессии HKDC1 — митохондриального белка, который поддерживает митохондриальную потенцию и запускает PINK1-Parkin-опосредованный митофагический процесс. Это способствует удалению поврежденных митохондрий и восстановлению клеточного гомеостаза, предупреждая тем самым клеточное старение.
Иммунная система также тесно связана с регуляцией клеточного старения. Несколько исследований показывают, что цитокины типа 2, такие как интерлейкин-4 (IL-4), способны замедлять старение макрофагов за счёт активации пути STAT6, который усиливает экспрессию генов, отвечающих за репарацию ДНК. Это продлевает функциональный ресурс иммунных клеток и улучшает состояние тканей. Однако важно понимать различие между «иммуносенесценцией» — возрастным нарушением иммунной функции, и классическим клеточным старением, поскольку эти процессы, хоть и связаны, но имеют разные молекулярные основы и последствия. Важное значение для понимания сосудистых заболеваний и процессов старения клеток также имеет связь сенесценции с ферроптозом — формой программируемой клеточной смерти, обусловленной накоплением железа и липидной пероксидацией.
В сосудистых гладкомышечных клетках неадекватно активированный ферроптоз вызывает дефицит NAD+, нарушает репарацию ДНК и запускает клеточное старение. Регуляция оси PPAR-γ–NCOA4–ферритин предотвращает ферроптоз и снижает индуцированное железом повреждение, тем самым уменьшая развитие артериальной жесткости и сосудистых нарушений. На уровне посттранскрипционной регуляции большое значение имеют модификации РНК, особенно метилирование по позиции N6-метиладенозина (m6A). Протеин WTAP, входящий в состав комплекса метилтрансфераз m6A, был связан с индуцированием клеточного старения в коже путём модификации мРНК транскрипционного фактора ELF3. В свою очередь, ELF3 активирует ген IRF8, участвующий в запуске процессов старения и выделения SASP-факторов, что способствует старению кожи.
Примечательно, что WTAP может играть разную роль в разных типах тканей, выступая как индуктор старения в одних, и антисенесцентный фактор в других. Роль клеточного старения в онкологии характеризуется двойственным эффектом. С одной стороны, оно препятствует трансформации клеток и их неконтролируемому делению, действуя как противораковый барьер. С другой стороны, присутствие в опухолевой ткани сенесцентных клеток с активным SASP способствует прогрессии опухоли, метастазированию и сопротивлению терапии. Молекулярные механизмы такого эффекта до конца не изучены, однако, предположение о создании иммунносупрессивной микросреды является ведущим в современной онкологической науке.
Интересно, что анализ протеинов, регулирующих клеточное старение, выявил высокое содержание так называемых intrinsically disordered proteins — белков с высоким уровнем структурной неупорядоченности. Это свойство обеспечивает необходимую функциональную пластичность и множественность взаимодействий, что важно для процессов регуляции, адаптации и передачи сигналов в клетках. Например, ключевые белки p53, p21, p16 и множество других обладают такими структурными особенностями, что позволяет им гибко реагировать на разнообразные клеточные стрессы и обеспечивать комплексность регулируемых процессов старения. В целом, современное понимание клеточного старения показывает, что это сложный и многоуровневый процесс, включающий в себя геномные, эпигеномные, метаболические, иммунные и посттранскрипционные изменения. Регуляция старения клеток осуществляется через скоординированную работу множества белков, сигнальных путей и факторов, которые интегрируют информацию о состоянии клетки и среды.
Потенциальное влияние клеточного старения на развитие возрастных заболеваний вынуждает углублять фундаментальные знания и искать новые терапевтические подходы, такие как использование сенолитиков, таргетированных молекул для улучшения репарации ДНК, регуляция митофагии и модуляция иммунной функции. Многообещающим направлением является также изучение роли модификаций РНК, биологии мембранно-неограниченных органелл и особенности intrinsically disordered proteins, что открывает новые горизонты для понимания и контроля клеточного старения. Таким образом, прогресс в этой области не только расширяет биологические знания, но и закладывает основу для разработки эффективных стратегий замедления старения и лечения связанных с ним заболеваний.