Гепарин занимает ключевое место в практике интенсивной терапии благодаря своей способности быстро и эффективно снижать свертываемость крови, что особенно важно при лечении тромбозов и профилактике тромбоэмболических осложнений. Его использования требует тщательного контроля и понимания фармакологических особенностей, так как неправильная дозировка может привести к серьезным последствиям, включая либо кровотечения, либо образование тромбов. В интенсивном отделении контроль антикоагуляции с помощью гепарина - это постоянный вызов для врачей из-за индивидуальной вариабельности реагирования пациентов и сложности лабораторных методов мониторинга. Фармакология гепарина основана на его влиянии на множество факторов свертывания крови. Нефракционированный гепарин - смесь полисахаридов различной длины, которая действует через связывание с антитромбином III, усиливая его ингибирующее воздействие на фактор IIa (тромбин) и фактор Xa.
Именно благодаря такой непрямой активации антитромбина гепарин эффективно препятствует формированию фибринового сгустка. Однако этот механизм делает эффект гепарина зависимым от уровня антитромбина в организме пациента, что особенно актуально у критически больных с нарушениями коагуляционной системы. Низкомолекулярные гепарины (НМГ) представляют собой фрагменты менее 18 сахаридных единиц и имеют ряд отличий от нефракционированного гепарина. Они преимущественно ингибируют фактор Xa и обладают более предсказуемой фармакокинетикой, что делает их удобными для использования вне стационара и при профилактических схемах. Однако в условиях интенсивной терапии, где требуется быстрое и точное регулирование антикоагуляции, применение нефракционированного гепарина остается стандартом.
Путь введения гепарина всегда парентеральный - внутривенно или подкожно. Несмотря на часто встречающиеся мнения о низкой биодоступности при подкожном введении (обычно 20-30 %), в условиях стационара, особенно в интенсивной терапии, внутривенная инфузия позволяет создавать стабильные и предсказуемые концентрации препарата. Сложность заключается в фармакокинетике гепарина, которая включает начальную быстроиспользуемую фазу и последующую более медленную элиминацию, причем при увеличении дозы период полувыведения удлиняется. Это проявление нелинейной кинетики требует внимательной настройки дозы. Мониторинг терапии гепарином традиционно основан на контроле активированного частичного тромбопластинового времени (аЧТВ).
АЧТВ отражает скорость свертывания плазмы и теоретически коррелирует с уровнем антикоагулянтного эффекта. Тем не менее, аЧТВ как тест не лишен ограничений. Во-первых, существует большое количество различных методик проведения анализа, большинство из которых имеют разную чувствительность к гепарину и зависят от используемых реагентов и оборудования. Это приводит к тому, что целевые диапазоны аЧТВ необходимо определять в каждом медицинском учреждении отдельно. Во-вторых, показатели аЧТВ сильно влияют на ряд прецизионных факторов: качество забора крови, температура хранения, наличие воспалительных процессов, состояние пациента (например, анемия или изменения гематокрита), что значительно затрудняет интерпретацию результатов.
Критически больные пациенты представляют отдельную группу риска, так как часто имеют комплексные нарушения гемостаза, измененный обмен веществ и пролитический статус, что делает реакцию на гепарин непредсказуемой. Из-за этих ограничений в последние годы все чаще стал использоваться метод измерения анти-Xa активности. Этот анализ оценивает способность плазмы ингибировать активность фактора Xa в присутствии гепарина, позволяя тем самым косвенно определять концентрацию гепарина в крови. Преимущество анти-Xa метода в большей специфичности и меньшей зависимости от иных факторов свертываемости. Тем не менее, он требует специализированных реагентов и оборудования, что ограничивает его доступность во многих лечебных учреждениях.
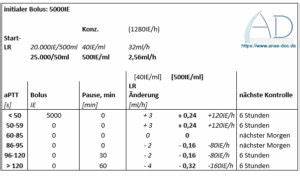
Аналитическая вариабельность между лабораториями и высокая стоимость также являются минусами этого метода. Практическая необходимость в точном контроле антикоагуляции диктует применение стандартных протоколов дозирования и мониторинга. В условиях интенсивной терапии часто используются номограммы, регламентирующие исходные дозы болюсного введения и непрерывных инфузий гепарина с последующими коррекциями на основе результатов контроля аЧТВ или анти-Xa. Такие схемы призваны уменьшить число ошибок и снизить варьабельность ответов у пациентов. Особое внимание уделяется проблеме гепарин-резистентности - состоянию, при котором стандартные дозы гепарина не вызывают ожидаемого увеличения времени свертывания, что связано либо с недостаточностью антитромбина III, либо с другими нарушениями коагуляционной системы.
В таких случаях рекомендуют использовать альтернативные маркеры контроля, например, активность анти-Xa или дозированный антитромбин, а также рассматривать возможность назначения дополнительных средств. Профилактическое назначение гепарина в отделениях интенсивной терапии зачастую проводится без целевого контроля аЧТВ, ориентируясь на фиксированные дозы, которые редко приводят к значительным осложнениям. Например, инфузия гепарина в дозировке около 10 000 МЕ в сутки применяется для предотвращения тромбообразования при наличии высокого риска, но без намеренного достижения удлиненного времени свертывания. Такой подход требует учета индивидуальных факторов и регулярной оценки клинической картины. Нельзя не упомянуть и о взаимодействии гепарина с другими методами лечения, особенно при проведении цитратной диализа, где антикоагуляция приобретает дополнительные особенности.
Цитрат снижает свертываемость в аппарате диализа, но не влияет на системную коагуляцию после восстановления уровня кальция. В такой ситуации многие специалисты предпочитают использовать низкомолекулярные гепарины для профилактической антикоагуляции, при этом контролируя гемодинамику и эффективность лечения. В целом, антикоагуляция гепарином на интенсивной терапии - процесс динамичный и требующий комплексного подхода. Идеальный контроль терапии на сегодняшний день невозможен без использования адаптированных протоколов, постоянного мониторинга и учета индивидуальных характеристик пациента. Врачам нужно быть готовыми к нестандартным ситуациям, связанным с лабораторными отклонениями и измененной фармакокинетикой, а также соблюдать баланс между риском кровотечения и тромбоза.
Современные исследования показывают, что снижение частоты и тяжести осложнений возможно при соблюдении четких протоколов использования гепарина, включающих своевременные лабораторные тесты и интерпретацию результатов с учетом локальных особенностей. Развитие методов мониторинга, включая анти-Xa, и интеграция новых технологий обещают сделать антикоагуляцию более безопасной и предсказуемой. Таким образом, гепарин остается незаменимым средством антикоагуляции в отделениях интенсивной терапии, но его применение требует высокого профессионализма и индивидуального подхода. Оптимизация схем дозирования и контроля позволит минимизировать риски и повысить эффективность лечения критически больных пациентов, нуждающихся в надежной защите от тромботических осложнений. .