Воспалительные заболевания кишечника (ВЗК) остаются одной из наиболее сложных и распространённых проблем современной медицины. Учитывая хронический характер болезней, таких как болезнь Крона и язвенный колит, поиск эффективных и безопасных методов терапии особенно актуален. Современная наука делает значительные шаги вперёд благодаря развитию молекулярных технологий и инновационных способов доставки лекарственных средств. Одним из таких перспективных направлений является использование зафиксированных нуклеиновых кислот (locked nucleic acids, LNA), доставляемых в клетки с помощью липидных наночастиц (lipid nanoparticles, LNP). Эти два компонента в сочетании открывают новый путь к эффективному таргетированию воспалительных процессов в кишечнике с минимальными побочными эффектами.
Зафиксированные нуклеиновые кислоты представляют собой третье поколение антисенсовых олигонуклеотидов. Особенность LNА заключается в структурной модификации рибозного кольца, где атомы углерода фиксированы замкнутым химическим мостиком. Такая конструкция обеспечивает чрезвычайно высокую аффинность и специфичность связывания с целевыми последовательностями РНК, что значительно повышает эффективность подавления экспрессии патологических генов. Однако несмотря на свои преимущества, LNА требуют высоких доз для достижения терапевтического эффекта, что нередко приводит к нежелательным побочным эффектам, в том числе токсичности. Проблема эффективной доставки лекарственных олигонуклеотидов к органам-мишеням была решена благодаря нанотехнологиям.
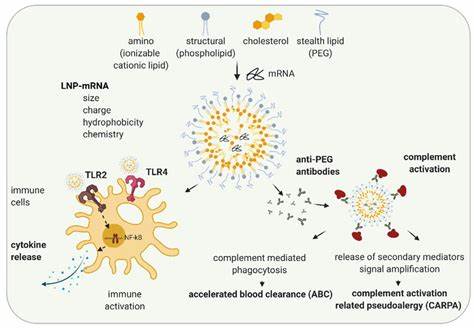
Липидные наночастицы, обладающие уникальными свойствами биосовместимости и способностью преодолевать клеточные барьеры, стали ведущим инструментом в доставке нуклеиновых кислот. LNP состоят из нескольких компонентов, ключевыми из которых являются ионизационные липиды, холестерин, полиэтиленгликоль-липиды и вспомогательные липиды. Ионизационные липиды играют центральную роль, так как они адаптируют заряд наночастиц в зависимости от pH среды, обеспечивая взаимодействие с отрицательно заряженной нуклеиновой кислотой в кислой среде во время формирования LNP и минимизируя потенциально вредные взаимодействия с клеточными мембранами при физиологическом pH. Сегодня многие исследования демонстрируют эффективность LNP как платформы доставки ASO (антисмысловых олигонуклеотидов), включая LNА. В недавних экспериментах на мышах с воспалением кишечника было показано, что LNP, загруженные LNА, способны достичь воспалённых участков ткани и осуществить целенаправленное воздействие на молекулярные мишени воспаления с более чем 30-кратным снижением эффективной дозы по сравнению с незагруженными LNА.
Одной из главных мишеней в терапии воспалительных заболеваний кишечника является провоспалительный цитокин фактор некроза опухоли альфа (TNFα). Патологическая экспрессия TNFα напрямую связана с усилением воспалительного ответа и разрушением слизистой оболочки кишечника. Использование LNА, нацеленных на снижение уровня TNFα, уже продемонстрировало значительное улучшение клинического состояния у животных с моделью колита. При этом encapsulation в LNP позволила не только повысить биодоступность LNА, но и снизить риск системной токсичности. Детальный анализ распределения LNP выявил, что после системного введения частицы достигают не только печени и селезёнки, но и воспалённого кишечника, где они аккумулируются в клетках, отвечающих за развитие воспаления.
Особенно заметное связывание наблюдается с эндотелиальными клетками, макрофагами и нейтрофилами - ключевыми участниками иммунного ответа при ВЗК. Такая селективность насыщает терапевтический потенциал и минимизирует нецелевые эффекты. С точки зрения безопасности, эксперименты показали, что лечение LNP с LNА не сопровождается повышением уровня печёночных ферментов, что свидетельствует о низкой гепатотоксичности. Кроме того, гематологические показатели животных оставались в пределах нормы, что говорит о хорошей переносимости терапии. Это особенно важно, учитывая, что большинство появляющихся препаратов для лечения ВЗК вызывают ряд нежелательных реакций при длительном применении.
Разработка и подбор ионизационных липидов для LNP играют решающую роль в эффективности доставки. В ходе исследований синтезировали и тестировали библиотеку из восьми различных липидов с различными гидрофобными цепочками и функциональными группами. Из них выделили три лидирующие формулы, показавшие оптимальное сочетание стабильности, эффективности доставки и безопасности. Лучшей из них стала формула на основе липида с линолеиновой гидрофобной цепочкой и биодеградируемыми эстерными связями, что обеспечило уникальные характеристики для преодоления биологических барьеров и способствовало быстрой доставке активного вещества в клетки кишечника. Важным этапом оценки эффективности выступили in vitro и in vivo тесты с использованием модели сплайсингового переключателя на альтернативный изоформу транскрипта Hif1α.
Данный метод позволил с высокой точностью оценить уровень проникновения и действия LNА, приложенных с помощью различных LNP. Результаты подтвердили превосходство выбранных наночастиц над свободными LNА и другими формулами, что расширяет потенциал для клинического применения. Терапевтические испытания на модели колита у мышей продемонстрировали значительные преимущества применения LNА, доставляемых LNP. Животные, получавшие лечение с использованием LNP, показали снижение симптомов заболевания, уменьшение веса тела, улучшение морфологии кишечника и значительное снижение провоспалительных цитокинов не только TNFα, но и IL-6 и IL-1β. Гистологическое исследование тканей подтверждало восстановление эпителиальной целостности и снижение воспалительной инфильтрации.
Несмотря на большое количество достигнутых результатов, исследователи подчёркивают необходимость дальнейших разработок и оптимизаций. Основной вызов заключается в минимизации накопления LNP в непреднамеренных органах и обеспечении более точечного таргетирования именно клеток кишечника. В этой связи перспективным направлением является модификация поверхности LNP с использованием специфических молекул-мишеней, таких как антитела или пептиды, распознающие рецепторы воспалённых тканей. Кроме того, расширение клинических исследований с использованием более физиологично правдоподобных моделей воспалительных заболеваний позволит подтвердить безопасность и эффективность технологий в приближённых к человеческим условиях. Внедрение новых биомаркеров и методов визуализации поможет отслеживать динамику распределения и действия терапевтических агентств.
В глобальном контексте применение антисанцевых олигонуклеотидов с использованием LNP меняет парадигму лечения заболеваний, требующих регуляции генетической экспрессии. Высокая специфичность, низкая иммуногенность и возможность системной доставки делают эту технологию одной из наиболее перспективных для создания персонализированных медицинских препаратов с минимальным риском токсических эффектов. В заключение, использование липидных наночастиц для доставки зафиксированных нуклеиновых кислот представляет собой значительный прорыв в борьбе с воспалительными заболеваниями кишечника. Данные технологии способны обеспечить целенаправленное уменьшение воспаления при сохранении безопасности для организма. Они открывают путь к новым поколениям препаратов, обладающих высокой эффективностью, улучшенной биодоступностью и потенциалом для индивидуализированного подхода в терапии.
Продолжающиеся разработки и клинические испытания возлагают большие надежды на скорое появление инновационных решений для миллионов пациентов по всему миру, страдающих от хронических кишечных воспалений. .



![Meta Connect 2025 [video]](/images/DF881F01-2EB4-4262-9A17-4E1E0BDA181D)



