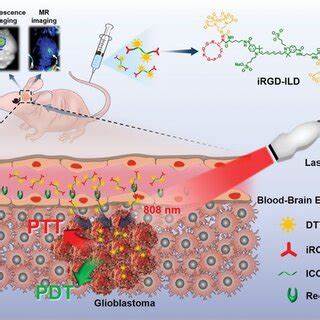
Глиобластома является одной из наиболее агрессивных и трудноизлечимых форм рака головного мозга. Высокая инвазивность опухоли, а также ее гетерогенность создают значительные препятствия для эффективного лечения, в частности хирургического удаления. Одной из ключевых задач при операции по удалению глиобластомы является четкое выявление границ опухоли, чтобы максимально иссечь патологические клетки и одновременно сохранить функции мозга. В последние годы в медицинских исследованиях возникла необходимость разработки новых технологий визуализации, способных обеспечить хирургам возможность видеть пораженные зоны в реальном времени и с высокой точностью. В этом ключескую инновацией стала разработка ближнего инфракрасного (БИК) молекулярного зонда на основе жирных кислот, который открывает перспективы в области визуально-направленной хирургии глиобластомы.
Метаболизм жирных кислот играет центральную роль в поддержании жизнедеятельности раковых клеток. Многие опухоли, включая глиобластому, демонстрируют значительную переориентацию метаболических путей, повышая потребление и использование жирных кислот для получения энергии и построения клеточных структур. Это связано с необходимостью быстрого роста и выживания в условиях гипоксии и дефицита питательных веществ. Понимание механизмов липидного обмена не только расширяет базу знаний по биологии опухолей, но и служит фундаментом для создания инструментов диагностики и терапии, нацеленных именно на эти метаболические особенности. Создание молекулярного зонда FA-ICG, который представляет собой конъюгат пальмитиновой кислоты с клинически одобренным флуорофором индосцианином зеленого (ICG), позволяет избирательно и с высокой чувствительностью выявлять зоны повышенного потребления жирных кислот в тканях.
Преимущество этого зонда заключается в использовании БИК диапазона с длиной волны около 780 нм для возбуждения и 820 нм для эмиссии, что обеспечивает высокую проникающую способность света и минимальное фоновое свечение тканей. Такие свойства гарантируют высокий контраст и точность визуализации даже при глубоком расположении опухолевого очага. FA-ICG не просто накапливается во всех тканях, а подчиняется естественным процессам транспорта жирных кислот. Это подтверждается экспериментами на клеточных культурах 3T3-L1, где дифференцированные адипоциты, обладающие естественной способностью поглощать жирные кислоты, демонстрируют значительно большую локализацию зонда по сравнению с фибробластами. При этом стимуляция инсулином усиливает захват зонда адипоцитами, что подтверждает физиологичность механизма его проникновения в клетки.
Опыт использования FA-ICG в различных клеточных линиях показывает, что глиобластомные клетки обладают повышенным захватом этого зонда, особенно линии U87-MG. Конкурентное воздействие с естественной жирной кислотой — олеиновой — последовательно снижает интенсивность флуоресцентного сигнала, что говорит о специфичности взаимодействия с переносчиками жирных кислот и исключает неспецифическое накопление флуорофора. В работе с препарированными образцами глиобластомных ксенотрансплантантов на лабораторных моделях, FA-ICG демонстрирует яркий сигнальный фон в опухолевой зоне, который надежно отличим от нормальной ткани мозга. В сравнении с применением свободного ICG, который быстро выводится и обладает недостаточной селективностью, FA-ICG удерживается в опухолевой области значительно дольше. Это обеспечивает возможность проведения визуальной навигации при операции с увеличением отношения сигнал/шум, что крайне важно для минимизации риска остаточных опухолевых клеток.
Преимущества новейшего зонда становятся особенно заметны при проведении фундаментальных и доклинических исследований на моделях, близких к человеческим условиям, в частности при помощи образцов, взятых непосредственно от пациентов (PDX модели). Здесь FA-ICG способствует неинвазивной визуализации динамики роста опухоли, обходя необходимость в генетическом модифицировании клеток или применении радиоактивных изотопов. Отличительной чертой молекулярного зонда FA-ICG является его совместимость с современными операционными камерами, одобренными для клинического применения. Это обеспечивает беспрепятственную интеграцию технологии в хирургическую практику без необходимости приобретения специализированного оборудования. В опытах на мышах с ортотопическими опухолями глиобластомы, применение зонда позволило выполнить успешное иссечение опухоли с визуальной поддержкой, что в перспективе повысит эффективность хирургического вмешательства и улучшит результаты лечения пациентов.
Демонстрация успешного использования FA-ICG в хирургическом лечении собак с мастоцитомой — опухолью, имеющей сходную с человеческой гистологию и метаболизм — открывает перспективы расширения клинических испытаний на ветеринарные и последующие человеческие исследования. Низкие дозировки зонда, отсутствие токсичности и высокая устойчивость сигнала обеспечивают безопасное и надежное применение в условиях операционной. Важным аспектом является сравнительный анализ данного зонда с другими существующими методами визуализации опухолей головного мозга. Например, 5-аминолевулиновая кислота (5-ALA), используемая для навигации по опухолям, имеет ограничения в виде короткой глубины проникновения света, фоточувствительности, и недостаточной специфичности, что снижает эффективность применения. Свободный ICG, хоть и обладает лучшими спектральными характеристиками, более быстрым выводом и низкой специфичностью, требует больших доз и имеет повышенный фоновый сигнал.
В этом контексте FA-ICG соединяет преимущества обоих методов — специфичность, минимальную флуоресценцию окружающих тканей и стабильность in vivo. Помимо хирургии, FA-ICG может стать мощным инструментом для метаболического исследования опухолей, оценки эффективности лекарственных препаратов, направленных на липидный обмен, и других терапевтических стратегий, связанных с изменениями в метаболизме жирных кислот. Его использование в доклинических и клинических условиях позволит не только повысить точность диагностики, но и персонализировать лечение, ориентируясь на индивидуальный метаболический профиль опухоли. Одним из важных направлений будущих исследований станет оценка фармакокинетики и оптимизация формулировок FA-ICG, а также проведение широкомасштабных клинических испытаний для подтверждения безопасности и эффективности у пациентов с глиобластомой. С учетом текущих тенденций развития оптической хирургии и персонализированной медицины, данный молекулярный зонд способен изменить подход к лечению онкологических заболеваний головного мозга.
В заключение, ближний инфракрасный молекулярный зонд FA-ICG — это перспективная инновационная технология, идеально подходящая для решения задач визуально-направленной хирургии глиобластомы. Благодаря высокой специфичности, удобству применения и возможности интеграции с существующей операционной техникой, этот метод открывает новые уровни точности и безопасности хирургического лечения одной из самых сложных онкологических патологий. Его роль в будущем здравоохранении может быть значительной, способствуя улучшению выживаемости пациентов и снижению частоты рецидивов заболевания.