Бактерии, несмотря на свою кажущуюся простоту, обладают удивительной способностью изменять свою форму и механизмы роста. Одна из наиболее фундаментальных и одновременно сложных черт бактериальной жизни — процесс удлинения клеток, который влияет не только на размер и форму, но и на приспособленность бактерий к различным условиям среды. Фенотипическая пластичность удлинения клеток среди близкородственных видов, выявленная в ряде недавних исследований, пересматривает традиционные представления о стабильности и консервативности механизмов бактерий даже на близких эволюционных уровнях. Раскрытие этой пластичности открывает новые возможности для понимания адаптивных реакций, эволюции морфологии и потенциальных направлений развития антимикробных стратегий. Удлинение клетки у бактерий — это процесс, напрямую связанный с синтезом и перестройкой клеточной стенки, в частности муреина (пептидогликана).
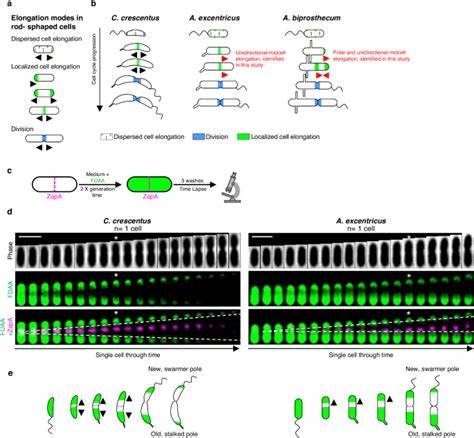
Пептидогликан формирует прочный каркас, обеспечивающий клетке структурную целостность и защиту. Синтез и ремоделирование муреина происходят благодаря деятельности пенициллин-связывающих белков (PBPs) и белков семейства SEDS, которые совместно действуют в крупных белковых комплексах — элонгазоме (клеточное удлинение) и дивизоме (клеточное деление). Традиционно считалось, что близкородственные бактерии, например виды внутри семейства Caulobacteraceae, используют схожие стратегии роста и удлинения. Однако недавние исследования с использованием флуоресцентных D-аминокислот (FDAA) привели к открытию разнообразных режимов удлинения даже в пределах одного семейства. В модели Caulobacter crescentus, хорошо изученном представителе Caulobacteraceae, удлинение происходит двунаправленно от середины клетки — то есть полиому синтезируются клеточная стенка и муреин с обеих сторон от делительной перегородки.
Но в родственных видах, таких как Asticcacaulis excentricus и Asticcacaulis biprosthecum, обнаружены уникальные особенности: у A. excentricus удлинение происходит в единственном направлении — от центра к новому полю клетки, а у A. biprosthecum — комбинированный режим с однополярным и односторонним удлинением от середины клетки. Такое открытие имеет важное значение, поскольку показывает, что эволюция удлинения клеток у бактерий связана не только с изменениями в геномном составе, но и с локализацией и активностью ключевых белков, таких как PBP2. В A.
excentricus, например, PBP2 концентрируется у центра клетки, направляясь в сторону нового полюса, и именно эта локализация определяет односторонний характер удлинения. В C. crescentus, напротив, PBP2 распределён более равномерно, что согласуется с его двунаправленной активностью. Интересно, что при ингибировании активности PBP2 с помощью антибиотика месиллинам клетки A. excentricus теряют направление роста и образуют патологические выпячивания, что подтверждает роль PBP2 как регулятора направленного удлинения.
Расширение спектра изучаемых видов показало, что помимо Caulobacteraceae, подобные механизмы встречаются и в других родственных таксонах. Изучение Rhodobacter capsulatus выявило односторонний рост с центра к полю бедра клетки, что демонстрирует широкое распространение пластичности в альфапротеобактериях. Чтобы глубже понять распределение и эволюцию различных режимов роста, учёные провели филогенетический анализ, который показал многообразие стратегий удлинения: от дисперсного роста по бокам клетки, полярного роста до комбинированных и односторонних модальностей. Выявлено, что эволюции этих механизмов способствовали не только структурные изменения в белках, но и регуляторные сдвиги, приводящие к изменению локализации и взаимодействия компонентов синтеза пептидогликана. Фенотипическая пластичность роста у бактерий демонстрирует гибкость, с которой микроорганизмы адаптируются к различным экологическим и физиологическим условиям.
Эта гибкость может быть вызвана необходимостью адаптироваться к дефициту питательных веществ, стрессовым воздействиям, конкуренции или даже к особенностям жизненного цикла. Например, поэтапное переключение от дисперсного роста к локализованному удлинению в течение цикла деления даёт бактерии возможность оптимизировать свою морфологию для конкретной фазы. Адаптивные преимущества этих пластичных стратегий обусловлены оптимизацией поглощения ресурсов, повышением устойчивости к повреждениям и усилением конкурентоспособности. Понимание фенотипической пластичности механизма удлинения клеток имеет также теоретическое значение для изучения эволюции бактериальных форм и функций. Морфология бактерий — ключевой фактор, который влияет на их экологические ниши и стратегии выживания.
Изменения в режиме удлинения могут прямо связаться с формированием специализированных структур, таких как выросты, аксиларные стенки или полярные структуры. В некоторых случаях модификации локализации пептидогликан-синтетических комплексов связаны с появлением новых морфотипов, что иллюстрирует тесную связь между молекулярной регуляцией роста и макроскопической формой бактерии. С практической точки зрения такие знания важны для разработки новых антибактериальных стратегий. Поскольку PBPs, особенно PBP2, являются основным таргетом бета-лактамных антибиотиков, понимание их локализации и функций может способствовать улучшению эффективности лекарств и предупреждению сопротивляемости. Более того, знание о вариативности и пластичности механизмов удлинения способно помочь в прогнозировании реакции бактерий на терапевтические воздействия и в выявлении уязвимых точек биохимических путей синтеза клеточной стенки.
Текущие научные подходы позволяют сочетать молекулярное мышление и современные визуализационные методы, такие как использование флуоресцентных D-аминокислот для отслеживания динамики пептидогликана. Это значительно расширяет возможности наблюдения реального времени за процессами удлинения у разных видов бактерий. Помимо культурных и генетических методов, филогенетический анализ помог установить эволюционные связи и показать, какие структурные изменения произошли в белках-участниках элонгазомы и дивизомы в разных родах и семействах. Однако остаётся много вопросов относительно механизмов, приводящих к специфической локализации PBP2 и других компонентов в различных видах. Как регулируется направленное накопление PBP2 в A.
excentricus? Какие белки выступают в роли сигнальных или структурных посредников в этой локализации? Возможно, другие компоненты клеточного аппарата или особенности пептидогликанового матрикса служат источниками такой регуляции. Аналогично, интересно исследовать, как именно комбинированные режимы удлинения в A. biprosthecum координируются на молекулярном уровне. Также перспективно изучить, как пластичность механизмов удлинения влияет на экологическую успешность и конкуренцию между близкородственными видами в естественных биотопах. Фенотипическая пластичность удлинения клеток среди близкородственных бактерий — это важный пример того, как микроорганизмы сохраняют гибкость морфогенеза при малых эволюционных расстояниях.




![AI safety index on model scoring released today [pdf]](/images/4E49EB0F-42B8-4036-A86C-A30DC6C4EE43)

