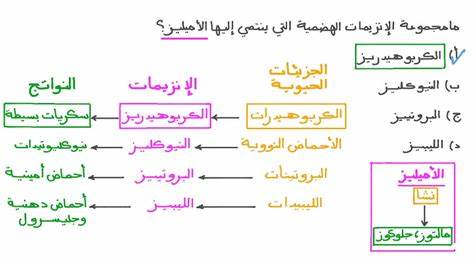
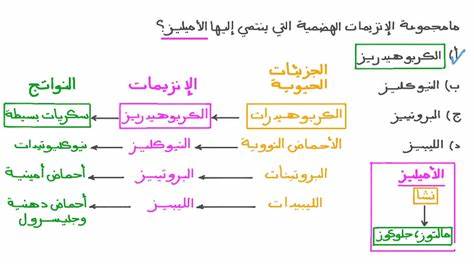
Фермент амилаза занимает важное место в биохимии и пищеварении благодаря своей способности эффективно расщеплять крахмал и другие сложные углеводы. Это гидролитический фермент, который катализирует превращение крахмала в большей степени в более простые сахара, такие как мальтоза и глюкоза, которые могут быть легче усвоены организмом. Амилаза особенно значима в поддержании нормального обмена веществ и процессах пищеварения у человека и животных, а также находит широкое применение в промышленности, включая производство продуктов питания и биотехнологию. Амилаза представляет собой группу ферментов, которые различаются по своей структуре и специфике действия. Существуют различные виды амилазы, включая альфа-амилазу, бета-амилазу, глюкоамилазУ и альфа-глюкозидазу.
Альфа-амилаза отвечает за гидролиз α-гликозидных связей внутри молекул крахмала, разрывая длинные цепи полисахаридов и образуя более короткие сахарные молекулы. В свою очередь, бета-амилаза способствует освобождению мальтозы из крахмала, действуя на концы цепочки. Глюкоамилаза и альфа-глюкозидаза завершают окончательное расщепление до глюкозы, что важно для всасывания сахаров в кишечнике. Процесс классификации и изучения свойств амилазы проходит несколько этапов. На первом этапе исследуются каталитические свойства ферментов, позволяющие отличить их активность и специфичность в зависимости от микробного или растительного происхождения.
Второй этап включает изучение структурных особенностей ферментов, таких как пространственное расположение активных центров, особенности аминокислотных последовательностей и доменных структур. Эти особенности определяют механизм действия, включая способы взаимодействия фермента с субстратом и процесс превращения. Последний этап направлен на изучение регуляции активности ферментов, как внутренней, так и внешней, а также на поиск промышленных применений, в частности для производства глюкозы, трегалозы и других продуктов из крахмала. Естественным источником амилазы для человека являются слюнные железы и поджелудочная железа. Слюнная амилаза начинает процесс расщепления крахмала уже в ротовой полости, обеспечивая предварительное переваривание углеводов до попадания пищи в желудок.
Несмотря на кислотную среду желудка, активность амилазы сохраняется благодаря защищающему действию слизи и слизи желудка, поддерживающей более щелочные условия рядом с ферментом. Поджелудочная амилаза продолжает процесс гидролиза в тонком кишечнике, что способствует полному усвоению углеводов. Механизм действия амилазы заключается в специфическом разрыве α-1,4-гликозидных связей, соединяющих молекулы глюкозы внутри крахмала и гликогена. Однако α-1,6-связи, присутствующие в некоторых разветвленных участках крахмала, не расщепляются амилазой, что требует участия других ферментов, например, дегидролаз и трансгликозилаз. Результатом гидролиза амилазой становятся мальтоза, мальтотриоза и α-декстрины, которые затем подвергаются дальнейшему расщеплению до глюкозы ферментами ворсинок кишечника.
Ферментативная активность амилазы может быть оценена разными методами, одним из самых простых и доступных является определение времени изменения цвета крахмала при взаимодействии с йодом. Крахмал с йодом приобретает синий оттенок, который становится коричневато-красным по мере расщепления крахмала амилазой. Чем быстрее происходит эта реакция, тем выше активность фермента. В биотехнологической и пищевой промышленности амилаза играет ключевую роль. Она используется при производстве хлебобулочных изделий для улучшения текстуры и вкуса, при изготовлении сиропов и глюкозных растворов, а также в производстве пива и спиртных напитков для ферментации крахмала.
Современные технологии позволяют получать ферменты амилазного ряда из микробных источников, что обеспечивает высокую стабильность и эффективность при различных температурах и pH. Кроме того, изучение молекулярной структуры амилазы привело к разработке инновационных промышленных процессов, таких как производство трегалозы — особого сахара с уникальными свойствами стабилизации белков и мембран. Применение таких ферментов расширяет возможности биотехнологий, делая их более экономичными и экологичными. В медицинском контексте изменение активности амилазы в крови или моче может служить диагностическим маркером различных заболеваний, включая панкреатит, заболевания слюнных желез и некоторые опухоли. Анализ уровня фермента помогает врачу оценить состояние пищеварительной системы и вовремя выявить отклонения от нормы.
Таким образом, амилаза — это не только ключевой фермент пищеварения, обеспечивающий расщепление и усвоение углеводов, но и важный промышленный инструмент с широким спектром применения. Понимание его структурных особенностей, механизмов действия и возможностей регулирования активности способствует развитию новых технологий и повышению качества продукции в различных отраслях. Это делает амилазу неотъемлемой частью современной биохимии, гастроэнтерологии и биотехнологии.