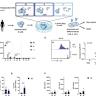
Стволовые клетки играют ключевую роль в поддержании гомеостаза тканей и их восстановлении после повреждений. Особое значение имеют покоящиеся или квази-спящие стволовые клетки, которые находятся в состоянии временного выхода из клеточного цикла, позволяя организму резервировать их для реактивации при необходимости регенерации. Несмотря на достижения в изучении этих клеток у лабораторных мышей, понимание работы стволовых клеток у приматов, в особенности у нечеловеческих, остается фрагментарным. Новые исследования, проведённые на сером мышином лемуре (Microcebus murinus), открывают перед наукой перспективы более точного моделирования человеческой физиологии и разработки эффективных стратегий по лечению мышечных заболеваний и возрастных изменений тканей. Серый мышиный лемур – уникальный объект для биомедицинских исследований благодаря своему небольшому размеру, быстрому размножению и физиологическому сходству с человеком.
В отличие от крупных макаков, которые могут служить моделями, но обладают высокой сложностью в обращении и продолжительным жизненным циклом, мышиный лемур предоставляет возможность изучать приматическую биологию без значительных трудностей, связанных с дорогостоящим содержанием и медленным воспроизводством. Ученые использовали современные методы одноклеточного секвенирования РНК (single cell RNAseq) и флуоресцентной цитометрии для выделения двум ключевым популяциям покоящихся стволовых клеток в мышечной ткани мышиного лемура – миогенным стволовым клеткам скелетной мускулатуры (MuSCs) и мезенхимальным предшественникам, известным как фибро-адипогенные прогениторы (FAPs). Успешная идентификация маркеров, таких как NCAM1 для MuSCs и THY1 для FAPs, позволила выделять эти клетки с высокой степенью чистоты и проводить их подробное функциональное исследование. Важным открытием стало подтверждение способности этих клеток к самообновлению и дифференцировке in vivo – они не только могут размножаться, восстанавливая численность стволовых клеток, но и эффективно дифференцироваться в мышечные волокна и другие клеточные типы. При этом мышиный лемур демонстрирует близость этих процессов к человеческой физиологии, уступая лишь лабораторным мышам, у которых наблюдаются отличия в скорости и активности клеточной активации.
Особенностью приматических MuSCs является более длительный период выхода из состояния покоя. Анализы показали, что клетки мышиного лемура и человека нуждаются примерно на 12 часов больше, чем клетки мыши, чтобы войти в фазу активного деления. При этом скорость последующих клеточных циклов сопоставима. Такое замедление активации связано с различиями в экспрессии ключевых молекулярных регуляторов, включая сниженное содержание транскрипционного фактора MyoD и повышенное выражение генов, связанных с поддержанием квазиквази-спящего состояния через сигналы NOTCH. Метаболические особенности этих клеток также оказались значимыми.
Обнаружены сниженные уровни полиамина спермидина, важного для успешного деления и пролиферации клеток. Эксперименты с химическими модификаторами указывали на то, что усиление деградации спермидина подавляет пролиферацию MuSCs, тогда как добавление спермидина стимулирует их рост, что может стать новым направлением для регуляции активности стволовых клеток при терапевтическом вмешательстве. Помимо миогенных стволовых клеток, FAPs представляют собой мультипотентный субстрат, способный к дифференцировке не только в клетки жировой ткани, но и в фибробласты и остеоциты. В исследованиях на мышином лемуре обнаружен ярко выраженный сдвиг в сторону адипогенной дифференцировки, что отражается большей способностью этих клеток создавать жировую ткань внутри мышц по сравнению с аналогичными клетками мыши. Такое явление связано с повышенной экспрессией фактора комплемента D (CFD), который традиционно рассматривают как компонент иммунной системы, но также выступает в роли адипокина, способствующего образованию жировой ткани.
Эксперименты с использованием ингибиторов CFD показали снижение адипогенной дифференциации FAPs и уменьшение жировой инфильтрации мышц после трансплантации клеток в модельных мышах. Эти результаты указывают на ключевую роль CFD в регуляции клеточной судьбы мезенхимальных предшественников у приматов и позволяют рассматривать мышиного лемура как модель для изучения процессов, связанных с миостеатозом – патологическим накоплением жира в мышцах, что часто наблюдается при старении и различных мышечных патологиях у человека. Дополнительным преимуществом исследования на мышином лемуре является то, что его клеточный состав мышечной ткани по своим характеристикам и генной экспрессии более близок к человеку, чем у других не человеческих приматов, таких как макаки. В частности, отсутствуют некоторые уникальные сосудистые популяции клеток, присутствующие у макак, что может означать меньшую специфику сосудистых адаптаций и более универсальную модель для исследований мышечной регенерации. Одним из наиболее значимых аспектов работы является выявление выраженных различий в экспрессии наследственных мышечных генов между видами.
Мышиный лемур демонстрирует генные экспрессии, привязанные к заболеваниям скелетных мышц, гораздо ближе к человеческим, чем мышь, что открывает перспективы моделирования наследственных и дегенеративных миопатий на примере этого мелкого примата. Примером является выявление выраженной экспрессии сплайсингового фактора HNRNPA1 – гена, мутации которого связаны с наследственными миопатиями и некоторыми формами нейродегенеративных заболеваний. Результаты исследования существенно расширяют инструментарий и понимание регуляции покоящихся стволовых клеток у приматов и подтверждают полезность серого мышиного лемура как модели для биомедицинских исследований, особенно в области старения, регенерации и мышечных заболеваний. Уникальный подход, сочетающий одноклеточный транскриптомный анализ и функциональные испытания с трансляционными экспериментами, позволяет изучать механизмы поддержания квази-покоя и механизмы выхода из них, что актуально для разработки новых методов регенеративной терапии человека. Исследование подчеркивает важность выбора максимально приближенной к человеку модели для изучения физиологии, регенерации и патологии тканей.
Учитывая различия в физиологии и клеточном составе среди видов, польза от использования мышиного лемура для изучения стволовых клеток уже стала очевидной, особенно с учётом возможности работы с меньшими животными при меньших затратах и с более коротким жизненным циклом по сравнению с макаками. В перспективе дальнейшее изучение механизмов, лежащих в основе задержанной активации стволовых клеток у приматов, а также выявление молекулярных мишеней для модуляции их пролиферативного потенциала может привести к созданию новых подходов в лечении мышечной дистрофии, саркопении и других заболеваний, связанных с ухудшением регенерации тканей. Кроме того, раскрытие роли молекулярных регуляторов судьбы мезенхимальных клеток, таких как CFD, открывает двери для разработки средств, направленных на ограничение патологического накопления жира в мышцах. Таким образом, работа по самообновлению и расширению покоящихся стволовых клеток у нечеловеческого примата прокладывает новый путь в понимании тонких механизмов человеческой регенерации и старения, демонстрируя глубокую связь молекулярной биологии, физиологии и медицины в стремлении улучшить качество жизни и здоровье.