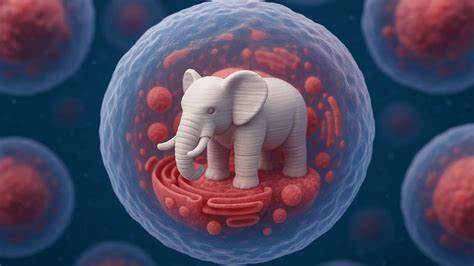
В последние годы технологии трехмерной печати стремительно развиваются, переходя от создания макроскопических объектов к удивительным миниатюрным конструкциям, способным функционировать внутри живых организмов. Одним из наиболее впечатляющих достижений стало 3D-печать крошечного слона размером всего десять микрометров внутри живой клетки. Это новаторское исследование открывает совершенно новое направление в науке о жизни и медицине, распахивая двери к невообразимым возможностям изучения клеточных процессов и разработке индивидуальных методов терапии. Трехмерная печать, применённая внутри клеток, базируется на технике, известной как двухфотонная полимеризация. Этот метод позволяет при помощи лазера инициировать процесс отвердевания специальной жидкой смолы, называемой фоторезистом, только в очень ограниченной области.
Благодаря сверхточному фокусированию лазерного луча происходит захват двух фотонов одновременно, что приводит к затвердеванию материала в форме, заданной исследователем. Основная сложность заключалась в том, чтобы выполнить этот процесс внутри живой клетки, не повредив её жизнедеятельность. Ученые вводили фоторезист внутрь клетки с помощью микропипетки, затем с помощью лазера создавали трехмерные микроструктуры, после чего лишний материал растворялся. Несмотря на то что многие клетки не выживали, значительная часть организмов перенесла процедуру без существенного ущерба, продолжая делиться и функционировать. Крошечный слон стал символическим воплощением грандиозности маленьких вещей и инновационного подхода к биологическим исследованиям.
Помимо эстетической ценности, микроструктуры разного рода, включая своеобразные «штрихкоды», могут служить своеобразными метками для отслеживания отдельных клеток, что крайне важно для изучения сложных биологических систем и процессов. Традиционные методы введения инородных объектов в клетки часто основаны на процессах фагоцитоза, когда клетка сама поглощает частицы. Однако этот способ ограничен определёнными типами клеток и не всегда применим при необходимости создавать детализированные структуры. 3D-печать в этом контексте позволяет получить необходимую форму и функциональность микроструктур внутри практически любого типа клеток. Одним из самых перспективных направлений является создание микролазеров внутри клеток.
Такие лазеры представляют собой крошечные сферы, которые при освещении могут усиливать и ограничивать свет, излучая его с характерными параметрами. Благодаря вариациям их размеров можно получить уникальные световые сигнатуры, что открывает возможность идентификации клеток и мониторинга изменений внутри них в реальном времени. Это революционный инструмент, который позволит ученым не только маркировать клетки, но и проводить сенсорный анализ их внутреннего состояния, выявляя наличие тех или иных биомолекул или патологических изменений. Интерес вызывает и потенциальное создание внутри клеток мельчайших механических устройств, таких как рычаги, пружины или барьеры, способных изучать и влиять на внутриклеточные силы. Такие микроструктуры помогут понять фундаментальные биофизические процессы, которые определяют поведение клеток, а также дадут новый импульс развитию наномедицины.
Несмотря на очевидные преимущества, технология пока находится на ранней стадии и требует дальнейших разработок для повышения безопасности и эффективности. Большая часть клеток всё ещё погибает в результате инъекций фоторезиста или из-за токсичности используемых материалов. Однако учёные ищут новые виды фоторезистов, которые смогут проникать через клеточные мембраны без необходимости механического вмешательства, что значительно повысит выживаемость. Кроме того, усовершенствованные методы инъекций и печати позволят снижать негативное воздействие. Когда это произойдёт, возможным станет применение данной технологии в клинической практике, например, для создания внутриклеточных биосенсоров, новых систем доставки лекарств или терапии рака, где вмешательство непосредственно в клеточные структуры крайне важно.
Эксперты отмечают, что возможность взаимодействия с клетками без изменения их генетического кода - серьезное преимущество. Многие современные методы биомедицины связаны с генетической модификацией, которая часто сопровождается этическими и техническими сложностями. 3D-печать микроструктур в клетках предлагает иной путь - физическое создание функциональных объектов, которые могут временно или постоянно изменять работу клеток, не затрагивая их наследственный материал. Символизм маленького слона, напечатанного внутри клетки, не случаен. Он демонстрирует, как большие идеи и сложные технологии могут отображаться в невероятно малых масштабах, открывая огромные научные перспективы.
Это достижение демонстрирует объединение физики, биологии, химии и инженерии, а также потенциал для трансформации исследований живых систем. Продвинутые методы, подобные описанным, будут способствовать развитию персонализированной медицины, создавая новые подходы к диагностике и терапии заболеваний на уровне отдельных клеток. Они позволят получать более глубокое понимание процессов жизни и смерти, взаимодействий между молекулами и комплексных реакций, протекающих в организме. Таким образом, 3D-печать микрообъектов внутри живых клеток становится мощным инструментом для будущего биотехнологий. Вскоре технология может стать стандартом для разработки инновационных медицинских приборов, биосенсоров и исследовательских платформ, изменив наше представление о возможностях взаимодействия человека и микромира.
Это пример того, как творческий подход и междисциплинарное сотрудничество двигают науку вперёд, преодолевая прежние границы возможного.