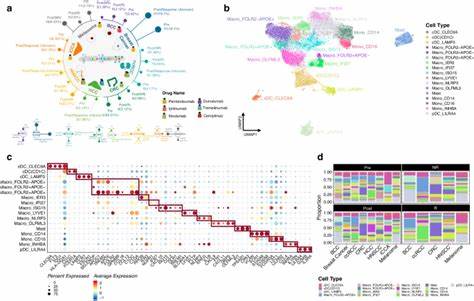
Опухолевая микросреда (ОМ) — это сложный биологический ансамбль, который включает не только раковые клетки, но и разнообразные иммунные и стромальные клетки, а также внеклеточные матриксы и различные сигнальные молекулы. Именно взаимодействие компонентов микросреды во многом определяет динамику развития опухоли, ее агрессивность, возможность метастазирования и, что очень важно, ответ на терапевтические вмешательства. Становится все более очевидным, что для прогноза успешности лечения и разработки новых терапевтических стратегий необходимо понимать состав и функциональное состояние клеток, населяющих опухоль. Однако традиционные методы исследования, такие как иммуногистохимия и одноклеточный секвенсинг, хотя и дают ценные данные, имеют ограничения, связанные с высокой стоимостью, технической сложностью и трудоемкостью. Современные цифровые методы анализа, основанные на деконволюции данных транскриптомики опухолей, предлагают эффективное решение.
Под деконволюцией понимается вычислительный процесс выделения доли разных типов клеток из смешанной популяции, представленой в массовых данных о генной экспрессии ткани. Такой подход позволяет играть на преимуществах огромных массивов уже собранных данных и получить понимание том микросреды на пан-клеточном уровне, охватывая десятки тысяч опухолевых образцов с различными типами рака. В ряде исследований были применены разнообразные алгоритмы деконволюции для выделения иммунных клеток, но чаще всего сосредотачивались на ограниченном числе типов клеток, не учитывая обширное разнообразие стромальных элементов и уникальные клеточные композиции, характерные для разных видов опухолей. Ограниченность этих методов, а также систематические отклонения в результатах привели к нехватке интегрированных данных, позволяющих построить комплексную картину ОМ среди раковых заболеваний. Последние достижения включают интеграцию результатов девяти различных методов деконволюции, что позволило оценить 79 различных клеточных типов микросреды в более чем десяти тысячах образцов опухолей, охватывая 33 основных типа рака.
Такая масштабность и разнообразие данных обеспечивают беспрецедентную детализацию и глубокий анализ вариабельности микросреды между опухолями и внутри отдельных подтипов рака. Полученные интеграционные показатели, или iScores, позволили выявить 41 уникальный паттерн распределения иммунных и стромальных клеток. Эти паттерны нефункциональны и своеобразны для каждого онкологического типа и его подтипов, подчеркивая гетерогенность микросреды. Например, оказалось, что количество лейкоцитов (клеток иммунной системы) — один из главных факторов, определяющих структурные особенности микросреды различных опухолей. Важным открытием стало то, что иммунно-насыщенный микрокластер часто ассоциируется с улучшенным вопросом прогноза для пациентов.
В частности, у пациентов с раком мочевого пузыря, относящимся к люминальному и базальному сквамозному подтипам, выявлена группа опухолей, у которых преобладает иммунный компонент микросреды. У таких больных наблюдалась более благоприятная прогностическая картина. Подобные закономерности выявлены и для меланомы, у которой RAS-путь активации в опухолевых клетках часто связывается с таким иммунным профилем. На уровне отдельных иммунных клеток отмечены неоднородные паттерны и различные корреляции с прогностическими исходами. Клетки цитотоксического типа (CD8+ T-лимфоциты), естественные киллеры, подтипы Т-хелперов и B-клеток, как правило, связаны с лучшим контролем опухолевого процесса.
В то же время повышенное содержание макрофагов, особенно иммуносупрессивных подтипов М2, зачастую указывает на неблагоприятный прогноз, например, при глиобластоме. Регуляторные Т-клетки, которые традиционно ассоциируются с подавлением антиопухолевого иммунитета, показали значимую связь с худшими исходами в почечно-клеточном раке. Это открывает возможности для таргетированной терапии с акцентом на снижение влияния данных клеток в микросреде. Сравнительный анализ стромальных клеток выявил, что их роль в опухолевом прогрессировании более сложна и зависит от контекста. Эндотелиальные клетки и перициты могут способствовать снижению риска прогрессии в одних опухолях, тогда как фибробласты, наоборот, часто ассоциируются с прогрессированием и агрессивным поведением опухолей.
Взаимодействие иммунных клеток со стромальными при этом оказывает ключевое влияние на динамику заболевания. Например, сочетание высокого уровня CD8+ T-клеток с низким содержанием фибробластов дает более благоприятный прогноз. Использование данных с интегрированными оценками микросреды позволило создать пан-клеточную карту опухолей, выявив множество кластеров с характерными особенностями состава клеток. Эти кластеры, в основном, зависели от ракового типа, но отражали существенную гетерогенность внутри заболевания. Это позволяет лучше понять взаимосвязь микросреды с молекулярными и клиническими особенностями опухолей.
Рассматривая конкретные примеры, было установлено, что у рака мочевого пузыря существует подгруппа опухолей с высокой иммунной инфильтрацией, что связано с большим количеством мутаций и, как следствие, потенциалом для возникновения новых антигенов. У пациентов из этой группы наблюдается более благоприятный прогноз. Аналогичный подход выявил два кластера в меланоме, где опухоли с активной мутацией в RAS-пути и богатой иммунной инфильтрацией оказываются более восприимчивы к прогрессированию и фармакологическим вмешательствам, таким как иммунотерапия. Что касается геномных особенностей, выяснилось, что мутации в ряде драйверных генов напрямую связаны с составом микросреды. Например, мутации в гене CASP8, регулирующем пути апоптоза и иммунного ответа, коррелируют с повышенным разнообразием и уровнем иммунных клеток.
Такие опухоли, по-видимому, запускают сложные механизмы иммунного уклонения. В противоположность им, мутации NRAS отрицательно влияют на разнообразие иммунных компонентов, что может свидетельствовать о формировании иммунного исключения и более агрессивном фенотипе. Мутации в FGFR3 в раке мочевого пузыря ассоциируются с иммунной супрессией, что подчеркивает возможности для клинической таргетной терапии, направленной как на опухолевые клетки, так и на микросреду. Анализ показал, что взаимосвязь между бременем мутаций (TMB) и уровнем иммунного инфильтрата не является однозначной и сильно зависит от типа рака. В совокупности, использование интегрированного подхода к деконволюции позволяет получить комплексную картину иммунного и стромального микросреды раковых опухолей, обеспечивая ценные знания для прогнозирования клинических исходов и разработки новых терапевтических стратегий.
Данные могут быть успешно применены для улучшения персонализированной медицины в онкологии, а также для выявления новых биомаркеров и мишеней для иммунотерапии. В перспективе, данные методы и результаты могут стимулировать дальнейшие исследования в области пространственной транскриптомики, мультиомики и интегрированной системной биологии, что позволит учитывать не только тип и количество клеток, но и их ориентацию и функциональное состояние в трехмерном пространстве опухоли. Это станет важным шагом вперед к пониманию сложных взаимодействий в микроопухолевой среде и улучшению исходов пациентов с раком.