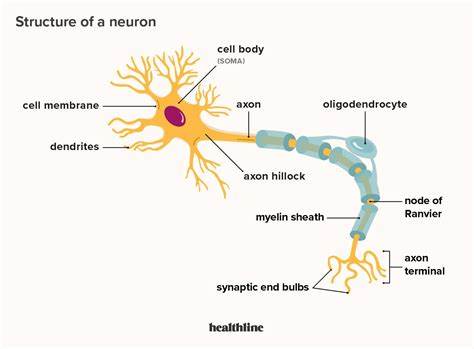
В течение десятилетий устоявшееся мнение о том, что мозг и, в частности, нейроны, являются абсолютно зависимыми от глюкозы для получения энергии, доминировало в биомедицинских науках. Учебники, исследования и клиническая практика многократно подчеркивали, что именно глюкоза служит главным и почти единственным источником топлива для деятельности нейронов. Многочисленные транспортёры глюкозы, запущенные процессы глюконеогенеза в условиях дефицита глюкозы, а также практически полное отсутствие липидных капель в клетках мозга воспринимались как бесспорные доказательства этой доктрины. Однако современные исследования и открытие редких наследственных заболеваний заставляют взглянуть на эту картину с новой точки зрения. Спектр так называемых наследственных спастических параплегий (HSP) — группа заболеваний с разнообразными мутациями — является ключевым звеном в понимании биохимии нейронов.
Особое внимание привлекает подтип HSP, связанный с мутациями в гене, кодирующем фермент DDHD2 — нейрон-специфическую триглицеридную липазу. Это достаточно неожиданное открытие: ведь считается, что нейроны не накапливают триглицериды и не используют их в качестве источника энергии. Тем не менее у пациентов с HSP54 наблюдается накопление триглицеридных капель в нейронах, что указывает на нарушенный метаболизм липидов. Такая аномалия в метаболической активности нейронов противоречит прежней концепции. Если рассматривать другие метаболически активные ткани — например, мышцы или печень — наличие и использование липидных запасов для получения энергии не вызывает удивления.
Митохондриальная бета-окислительная система даёт им возможность окислять жирные кислоты, обеспечивая значительный энергетический ресурс. Мозговая ткань раньше считалась исключением из этого правила — её метаболизм воспринимался как специфический, основанный преимущественно на глюкозе и гликолизе. Экспериментальные данные из недавних исследований показывают, что функция DDHD2 особенно важна в синаптических терминалях нейронов, и что блокада активности этого фермента приводит к снижению выработки АТФ в аксонах. Более того, торможение транспорта жирных кислот в митохондрии имеет сходные последствия, сопровождающиеся накоплением триглицеридных капель. Эти наблюдения позволяют сделать вывод, что некоторые нейроны действительно используют триглицериды для энергетического обмена посредством окисления жирных кислот — то есть не только глюкоза, но и липиды задействованы в поддержании их жизнедеятельности.
Подкрепляется это ещё и экспериментами, в которых предварительная загрузка нейронов пальмитиновой кислотой повышала их устойчивость к голоданию по глюкозе. Таким образом, долгое отсутствие липидных включений в нейрональных клетках объясняется не отсутствием их метаболизма, а постоянным процессом быстрого их использования в качестве топлива. Эти открытия ставят под вопрос прежние догмы и требуют пересмотра взглядов на нейронный энергетический метаболизм. Такой сдвиг в понимании работы мозга также служит напоминанием о том, что наука — это динамичная дисциплина, где даже казавшиеся очевидными истины могут быть опровергнуты новыми данными. Интересно отметить, что данное открытие имеет и философский аспект, связанный с современным отношением к искусственному интеллекту (ИИ) и машинному обучению.
Часто звучат предположения, что ИИ сможет в ближайшем будущем решать все сложнейшие научные вопросы. Однако если искусственные нейронные сети и алгоритмы учатся на основе уже существующих знаний, которые могут содержать ошибки или неполноту данных, то они с высокой вероятностью не смогут выдать неожиданное открытие, ранее не представленное в литературе. В случае с ролью DDHD2 и, более широко, липидного метаболизма нейронов, именно необходимость экспериментальной проверки и наблюдений позволила выявить эту новую информацию. Именно это ограничение современных ИИ-систем показывает, что человечество ещё множество открытий ждёт впереди, и роль учёных, исследователей и клиницистов остаётся ключевой. Врачам и биологам предстоит адаптировать свои подходы к патологиям нервной системы с учётом этих новых данных.
В частности, болезни, связанные с нарушениями липидного обмена, теперь можно рассматривать не только как второстепенные, но и как стратегически важные для понимания нейрональной физиологии и нейродегенеративных процессов. В долгосрочной перспективе это может открыть новые терапевтические возможности и подходы к лечению таких заболеваний. Понимание того, что нейроны используют не только углеводы, но и жиры как энергетический ресурс, вносит вклад и в развитие нейронаук в целом. Это расширяет рамки привычных биохимических моделей работы мозга и подсказывает возможные механизмы его адаптации и выживания в экстремальных условиях, например, при недостатке питательных веществ. Несомненно, дальнейшие исследования будут посвящены уточнению ролей различных типов нейронов, состояния их липидного метаболизма и взаимодействий клеточных и системных уровней.
Этот сдвиг в понимании энергетического обмена в нейронах — яркий пример того, как новые данные могут переворачивать устоявшиеся взгляды и стимулировать развитие науки. В конечном итоге такие открытия приближают нас к более полному знанию мозга, которое имеет значение для здоровья, медицины и технологий, связанных с искусственным интеллектом и биоинформатикой. Новые горизонты нейробиологии обещают не только изменить наши представления о том, как функционирует мозг, но и расширить наши возможности по улучшению качества жизни и лечению заболеваний, взаимосвязанных с функционированием центральной нервной системы.