Метастазирование является одним из самых сложных и опасных аспектов онкологических заболеваний. Большинство летальных исходов при раке связано именно с распространением опухолевых клеток в другие органы и ткани организма. Несмотря на значительный прогресс в диагностике и терапии первичных новообразований, лечение метастаз остается значительной клинической проблемой. Сложности обусловлены уникальными биологическими особенностями метастатических клеток и их микросреды, а также ограниченной проницаемостью тканей для противоопухолевых препаратов. В этой связи наномедицина демонстрирует огромный потенциал, открывая новые горизонты для эффективного и избирательного лечения метастаз.
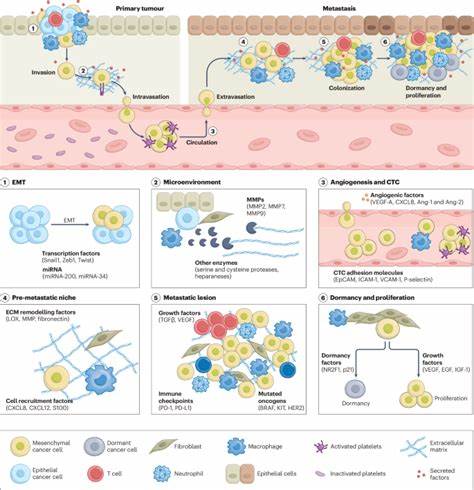
Наночастицы способны накапливаться в опухолевой ткани благодаря эффекту повышенной проницаемости и задержки (EPR), а также модифицироваться для активного таргетинга специфических молекулярных мишеней метастатической каскады. Таким образом, создаются возможности для комплексного и многоцелевого воздействия на процесс метастазирования. Метастазирование - сложный многоступенчатый процесс, включающий инвазию опухолевых клеток в окружающие ткани, проникновение в кровеносные или лимфатические сосуды (интравизация), циркуляцию в кровотоке, выход из сосудов (экстравизация) и колонизацию новых органов. Каждый из этих этапов контролируется специфическими биомолекулами и микроокружением, которые становятся потенциальными целями для терапии. Традиционные противоопухолевые препараты, как правило, ограниченно воздействуют на отдельные стадии процесса метастазирования и имеют недостаточную селективность, что приводит к системным побочным эффектам и снижению эффективности лечения.
Наноплатформы способны решать эти проблемы благодаря особым физико-химическим свойствам и возможности функционализации поверхности. Для изучения метастатического процесса и тестирования новых нанотерапий используются разнообразные препарциальные модели, начиная от двумерных клеточных культур и трехмерных сфероидов с включением компонентов опухолевого микросреды, заканчивая сложными животными моделями и органами на чипе. Эти системы позволяют имитировать биологические барьеры, типичные для метастаз, и оптимизировать конструкции наночастиц для повышения проникновения и накопления в потенциальных метастатических очагах. Исследователи также обращают внимание на важность изучения микроокружения метастаз, которое играет ключевую роль в поддержании жизнеспособности и колонизации опухолевых клеток. Наномедицины предлагают разнообразные стратегии для активного таргетинга метастаз.
Это включает использование лигандов, антител, пептидов и нуклеиновых кислот, способных распознавать специфические белковые или гликопротеиновые маркеры на поверхности метастатических клеток. Кроме того, разрабатываются стимул-чувствительные системы доставки, которые обеспечивают высвобождение терапевтических агентов при определенных условиях микроокружения опухоли, таких как низкий уровень pH, гипоксия или повышенная концентрация ферментов. Такая индуцируемая высвобождению лекарств локализация способствует максимизации воздействия на раковые клетки и снижению токсичности для здоровых тканей. Комбинации различных методов лечения в одном нанопрепарате становятся особенно актуальными. Так, с целью преодоления множественной лекарственной устойчивости и комплексного воздействия на метастазы применяются многокомпонентные комплексы, сочетающие химиотерапию, иммунотерапию, генотерапию и фототерапию.
Например, доставка малых интерферирующих РНК (siRNA) или микрорнк (miRNA), нацеленных на ключевые гены метастазирования, способствует подавлению инвазивных свойств опухолевых клеток. Параллельно система может содержать химотерапевтический препарат, усиливая общий терапевтический эффект. Иммунотерапия в сочетании с наномедициной представляет собой перспективное направление, направленное на преодоление иммунного подавления в опухолевом микросреде метастаз. Наночастицы позволяют эффективно доставлять иммуностимулирующие агенты и фрагменты белков, вызывающих иммунный ответ, что способствует активации клеток иммунной системы именно в зоне поражения. Такая селективность улучшает противоопухолевый эффект и минимизирует системную токсичность.
Особое внимание уделяется разработке наночастиц, способных проникать через биологические барьеры, такие как гематоэнцефалический барьер, что особенно актуально для лечения метастаз головного мозга. Кроме того, создание "умных" препаратов, реагирующих на внешние стимулы - тепло, свет, магнитное поле - позволяет контролировать время и место высвобождения лекарственного вещества, увеличивая его эффективность и безопасность. Одним из важных аспектов клинического перехода наномедицин для терапии метастаз является тщательный подбор пациентов с учетом молекулярного профиля опухоли и особенностей метастатического процесса. Стратификация пациентов позволяет максимально адаптировать терапию и повысить вероятность положительного исхода. В настоящее время около восьми нанопрепаратов уже одобрены для использования в клинической практике в борьбе с метастатическим раком, а более двадцати проходят клинические испытания.
При этом ведутся интенсивные исследования, направленные на улучшение дизайна частиц, уменьшение нежелательных эффектов и повышение специфичности таргетинга. Таким образом, наномедицина обладает значительным потенциалом для трансформации подходов к лечению метастазирующего рака. Благодаря возможности многоуровневого воздействия, высокой специфичности и безопасности, нанотехнологии позволяют создавать новые эффективные препараты, нацеленные на различные этапы метастатического каскада и способные модифицировать опухолевое микроокружение. Продолжающиеся исследования и развитие технологий обеспечивают открытие новых методов персонализированного и комплексного лечения, способного значительно продлить жизнь пациентов и повысить качество терапии. Интеграция наномедицины с иммунотерапией, генетическими и комбинированными подходами обещает существенный прогресс в борьбе со злокачественными метастазами, открывая новые горизонты в онкологии.
.