Клинические испытания препаратов для онкологического лечения традиционно сосредоточены на поиске универсальной дозы для всех пациентов, основываясь на статистических показателях токсичности, выявленных в группах участников. Такие дозоэскалационные протоколы, несмотря на распространенность, имеют существенные ограничения, связанные с отсутствием персонализации и гибкости дозирования. Тем не менее, современные исследования предлагают инновационные подходы, позволяющие расширить классические схемы и внедрить элемент титрации доз — постепенного подбора дозы для каждого пациента индивидуально. В основе нового взгляда на протоколы дозоэскалации лежит применение математических и концептуальных моделей, таких как категории и предпорядки, которые формализуют зависимости между состояниями испытаний и дозовыми уровнями. Такой подход позволяет четко определить правила повышения дозы с учетом фармакологических особенностей лекарств и этических принципов, направленных на снижение риска для пациентов.
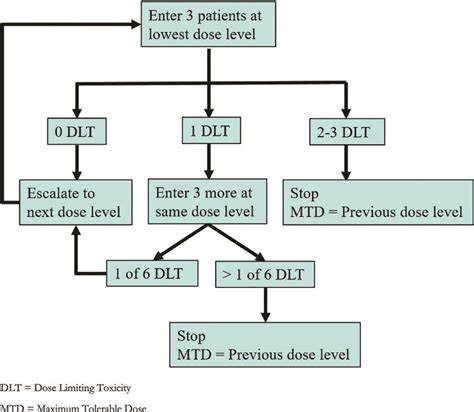
В частности, используются симметричные моноидальные предпорядки, отражающие монотонную природу токсичности препаратов при увеличении дозировки. Этическая составляющая играет немаловажную роль в разработке протоколов. Принцип постепенного повышения дозы обеспечивает минимизацию ущерба, избегая избыточной токсичности у участников. Традиционные методы, например, широко известный 3+3 дизайн, обладают достоинствами в простоте и знакомы многим исследователям, однако их анализ через призму новых математических моделей выявляет ряд недостатков. В частности, была обнаружена проблема, заключающаяся в немонотонных рекомендациях по дозированию, что может приводить к неоптимальному и даже потенциально опасному назначению исследуемого препарата.
Для устранения таких недостатков предлагается использование метода правого канонического расширения (right Kan extension), который трансформирует классический протокол с когорой из трех пациентов на более гибкую структуру, позволяющую непрерывное включение новых участников и адаптивный подбор дозировки. Это не только устраняет выявленную проблему с немонотонностью, но и улучшает процессы набора пациентов, позволяя ускорить сроки исследования без ущерба для безопасности. Внедрение титрации в протоколы дозоэскалации приносит значительные преимущества. Индивидуализация дозировки обеспечивает более точное соответствие терапевтических условий потребностям каждого пациента, учитывая его ответ на лечение и переносимость препарата. Это особенно актуально в онкологии, где вариативность индивидуальных реакций может быть высокой.
Гибридные протоколы, допускающие переход от классической дозоэскалации к адаптивному титрованию, способствуют более эффективному управлению токсичностью и потенцируют успех терапии. Однако на пути внедрения титрации в клинические испытания стоят сложные концептуальные, технические и регуляторные барьеры. Традиционные модели испытаний глубоко укоренены в нормативных документах и методологических стандартах, что замедляет переход к новым схемам. Технически адаптивное titration требует разработки сложного программного обеспечения и алгоритмов для оперативного анализа данных и принятия решений в реальном времени. Коммерчески исследования с индивидуализацией дозы могут столкнуться с возросшими затратами и неопределенностью в конечных выводах.
Инновационный математический аппарат, который формализует переход от протоколов дозоэскалации к протоколам с титрацией, часто опирается на идею монотонности доз и токсичности, что согласуется с фармакологическими интуициями. Запись протоколов в виде монотонных отображений предопределяет логичную и безопасную последовательность переходов между дозами, тем самым снижая риск ошибок и несоответствий в процессе испытаний. Это открывает возможности для разработки более прозрачных и воспроизводимых методик, которые смогут легче пройти экспертизу регуляторов и получить одобрение. Примером применения таких теоретических принципов служит исследование классического 3+3 протокола в рамках категориальной теории, которое выявило ранее неописанную проблему и предложило решение на основе правого расширения Канна. Этот прорыв иллюстрирует, как современные математические методы могут несложно интегрироваться в практику клинических исследований, повышая качество и безопасность испытаний.
Развитие современных протоколов, которые корректно учитывают индивидуальные особенности пациентов, способствует переходу онкологии к более персонифицированному лечению. Это не только уменьшает вероятность побочных эффектов, но и повышает эффективность терапии за счет точного подбора оптимальной дозы. В долгосрочной перспективе такие трансформации могут изменить стандарты клинических исследований, сделать их более гибкими и ориентированными на пациента, что является важной задачей для современной медицины. В заключение, интеграция титрации в дозоэскалационные протоколы является перспективным направлением, способным вывести клинические испытания на новый уровень. Математическая формализация, использование концепций категории и монотонных отображений позволяет не только выявить подводные камни классических методов, но и предложить практические решения для их устранения.
Снятие барьеров на пути адаптивного титрования требует усилий со стороны научного сообщества, регуляторов и индустрии, однако получаемые преимущества очевидны — повышение безопасности пациентов, ускорение разработки лекарств и индивидуализация лечения. В условиях стремительного развития онкологии и фармакологии такие инновации становятся ключевыми факторами успеха и улучшения качества жизни пациентов по всему миру.