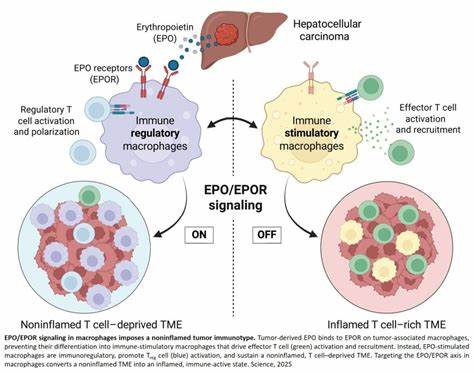
Онкологические заболевания представляют собой сложный и многоаспектный процесс, в котором иммунная система играет ключевую роль. Иммунитет способен распознавать и уничтожать раковые клетки, однако опухоли нередко вырабатывают механизмы, позволяющие им избегать успешного иммунного ответа. Одним из таких механизмов является реакция на эритропоэтин (ЭПО) – гормон, традиционно известный своей ролью в стимуляции образования красных кровяных клеток в костном мозге. Последние исследования показали, что эритропоэтин, вырабатываемый непосредственно опухолевыми клетками, функционирует как своеобразный иммуносупрессивный переключатель, способствующий уклонению рака от контроля иммунной системы. Роль ЭПО в организме давно ассоциировалась с поддержанием гомеостаза кислорода посредством регуляции эритропоэза.
Однако в контексте рака эта молекула приобретает новые функции. Высокий уровень опухолевого эритропоэтина обнаруживается особенно в гепатоцеллюлярной карциноме (ГЦК), одной из наиболее агрессивных форм рака печени. Примечательно, что повышенные уровни эритропоэтина в плазме пациента зачастую не связаны с признаками анемии, что свидетельствует о независимой роли гормона в патогенезе опухоли. В основе действия опухолевого ЭПО лежит его взаимодействие с рецептором эритропоэтина (EPOR), который экспрессируется не только на эритроцитарных предшественниках, но и на различных иммунных клетках микросреды опухоли, включая макрофаги, отвечающие за модуляцию иммунного ответа. Макрофаги играют двойственную роль: они могут либо стимулировать иммунный ответ, способствуя уничтожению опухоли, либо подавлять его, создавая благоприятные условия для роста опухолевых клеток.
Опухолевый ЭПО стимулирует EPOR, находящийся на макрофагах, что приводит к их репрограммированию в сторону иммунорегуляторного фенотипа. Такие макрофаги выделяют молекулы, способствующие развитию толерантности, увеличению числа регуляторных Т-клеток (Treg) и ослаблению активности цитотоксических CD8+ Т-лимфоцитов, которые являются главными исполнителями противоопухолевого иммунитета. Молекулярный механизм, лежащий в основе данного процесса, частично связан с активацией транскрипционного фактора NRF2, который индуцирует выработку антиоксидантов и способствует деградации гемовых молекул в макрофагах. Это приводит к снижению провоспалительного потенциала иммунных клеток и их переходу к иммунорегуляторному состоянию. Таким образом, через путь ЭПО-EPOR опухоль эффективно подавляет иммунный надзор и создает неинфламматорную, то есть «холодную» опухолевую микросреду.
Данные о том, что устранение эритропоэтина или блокада рецептора EPOR на макрофагах значительно усиливает иммунный ответ и способствует регрессии опухоли, открывают новые горизонты для лечения онкологических заболеваний. В экспериментах с моделями гепатоцеллюлярного рака с неинфламматорным микроокружением манипуляции с ЭПО-продуцирующими клетками или рецепторами на макрофагах приводили к увеличению инфильтрации CD8+ Т-клеток, усилению противоопухолевой активности и даже стиранию уже сформировавшихся опухолей. Кроме того, такие подходы хорошо сочетаются с иммунотерапией, особенно с ингибиторами контрольных точек, что подчеркивает потенциал комбинированных схем лечения. В клинической практике ранее применялись препараты, стимулирующие продукцию эритропоэтина для коррекции анемии у онкологических пациентов. Однако накопленные сведения свидетельствуют, что такая терапия при некоторых обстоятельствах может усугублять прогноз, способствуя росту опухоли.
Понимание механизмов действия опухолевого ЭПО позволит пересмотреть эти подходы и разработать более безопасные и целенаправленные методы лечения. Кроме гепатоцеллюлярного рака, повышенная экспрессия ЭПО и устойчивость к иммунному надзору отмечаются и в ряде других солидных опухолей, включая рак поджелудочной железы и предстательной железы. Это говорит о том, что феномен опухолевого эритропоэтина как иммуносупрессивного фактора является универсальным и может стать мишенью для новых противоопухолевых препаратов широкого спектра действия. Новые подходы в терапии, направленные на блокаду сигнального пути ЭПО-EPOR, включают разработку химерных рецепторов-декой, малых интерферирующих РНК, нацеленных на рецепторы на макрофагах, и молекулярных ингибиторов, стабилизирующих проиммунные функции иммунных клеток. Их применение в препринтных и доклинических исследованиях позволяет надеяться на расширение арсенала противораковых средств, способных преобразовать «холодную» опухоль в «горячую», то есть активизировать естественный иммунитет для борьбы с раком.
Таким образом, открытие роли опухолевого эритропоэтина как ключевого переключателя иммунного подавления открывает перспективы создания инновационных иммунотерапевтических стратегий. Использование знаний о взаимодействии ЭПО и EPOR на макрофагах позволит не только глубже понять биологию опухоли и иммунитета, но и разработать новые методы лечения, способные повысить эффективность борьбы с раком, улучшить прогноз пациентов и расширить возможности современной онкологии в целом.