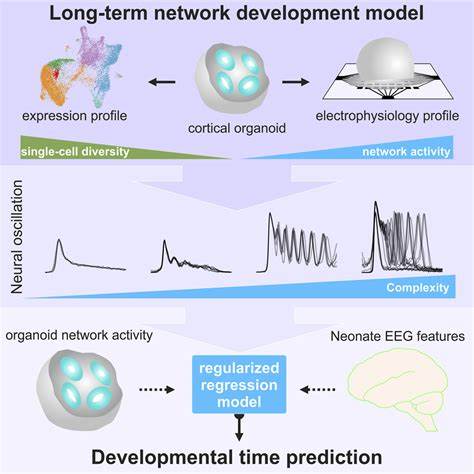
Кора головного мозга является центральным элементом, отвечающим за сложнейшие когнитивные функции, ощущения, моторику и эмоциональное поведение. Ее развитие начинается на самых ранних этапах эмбрионального периода с формирования специализированных нейронных стволовых клеток (НС-клеток), которые в дальнейшем дифференцируются в разнообразные типы нейронов и глиальных клеток. Несмотря на важность этого процесса, нарушения, возникающие в ходе раннего развития коры, способны привести к возникновению серьезных нейроразвивающих и кортикальных заболеваний, таких как микроцефалия, лиссенцефалия, гидроцефалия, а также расстройства аутистического спектра и другие неврологические патологии. Изучение же механизмов этих заболеваний долгое время оставалось ограниченным из-за трудностей работы с живым человеческим эмбриональным материалом. Однако современные технологии в области человеческих нейронных стволовых клеток и их моделирования в пробирке открывают новые горизонты для глубокого понимания этих процессов.
Природа кортикальных нарушений связана со сбоями в регуляции развития нейрональных стволовых клеток и их перехода в специфические нейрональные линии. НС-клетки, зарождаясь в пределах теленцефалона — переднего мозгового пузыря — претерпевают сложные стадии перехода, включающие образование радиальных глиальных клеток, нейрогенез и глиогенез. В ранних фазах эти клетки отвечают за поддержание и расширение популяции клеток, далее они становятся предшественниками глутаматергических возбуждающих нейронов, которые мигрируют в кору. Позже в кору поступают и ГАМК-ергические ингибирующие интернейроны, которые происходят из вентральной части теленцефалона. Значимость правильной организации этих процессов не должна быть недооценена — нарушения на любом из этапов могут стать причиной многочисленных кортикальных дисплазий и нейроразвивающих расстройств.
Современные исследования показали, что многие гены, ассоциированные с кортикальными и нейроразвивающимися расстройствами, проявляют активность уже в ранних стадиях развития нейронных стволовых клеток. Так, гены, связанные с микроцефалией, активны в фазах клеточного цикла и пролиферации в нервных стволовых клетках, указывая на важность своевременного и правильного деления клеток. Аналогично, другие генетические маркеры, связанные с гидроцефалией и лиссенцефалией, участвуют в регуляции региональной идентичности и миграции клеток в теленцефалоне. Что особенно интересно, в моделях на основе человеческих индуцированных плюрипотентных стволовых клеток (hiPSC) были воспроизведены эти сложные последовательности развития, что позволяет наблюдать эти процессы и их сбои в контролируемых условиях in vitro. Используя методики последовательного культивирования и стимуляции генных путей, ученые могут моделировать переходы между разными типами нейронных стволовых клеток и отслеживать динамику экспрессии генов, связанных с различными кортикальными расстройствами.
Так, повышение или снижение уровня определенных транскрипционных факторов в разные моменты развития NSC могут приводить к специфическим нарушениям в этих переходах, а следовательно — к развитию различных форм патологий мозга. Важной особенностью исследований является выявление критических временных окон — фаз развития нейронных стволовых клеток, когда их уязвимость к генетическим нарушениям максимальна. Например, наблюдается, что микрогении и онтогенетическое развитие глутаматергических нейронов связаны с определенными этапами прогрессии NSC. Нарушение в эти периоды может привести к специфическим заболеваниям, что дает ценную информацию для позиционирования терапевтических вмешательств в нужное время. Кроме того, анализ сетевых взаимодействий транскрипционных факторов и их регуляторных мишеней указывает на сложные взаимосвязи, которые могут объединять ряд различных кортикальных расстройств.
Специализированные транскрипционные сети, выявленные в моделях NSC, демонстрируют, как одни и те же гены могут участвовать в патогенезе нескольких болезней, выступая либо в роли хабов, либо периферийных узлов. Это объясняет феномен гетерогенности клинической картины и частичной перекрываемости симптоматик при различных кортикальных нарушениях. Последнее время получила широкое распространение технология многоомного анализа на уровне отдельных клеток — совмещение транскриптомики и оценки открытости хроматина. Использование таких инновационных платформ позволяет моделировать влияние точечных генетических нарушений на траектории клеточного развития и прогнозировать потенциал восстановления или усугубления патологий. В частности, моделирование инактивации ключевых транскрипционных факторов с помощью инструментов искусственного интеллекта показывает различные состояния и переходы клеток, определяющие судьбу формирования коры и глии.
Особый интерес вызывают исследования, посвященные изучению стволовых клеток, полученных от пациентов с расстройствами аутистического спектра. Эти исследования выявляют значительные вариации в экспрессии генов, регулирующих раннюю сегрегацию и региональное распознавание клеток в мозге. Появляются данные, свидетельствующие о сдвиге баланса между антеровентральными и дорзопостериорными паттернами развития у пациентов с аутизмом, что может служить основой для формирования характерных нейрофизиологических особенностей. Использование hiPSC и их дифференцированных производных в качестве моделей развития человеческой коры не только способствует идентификации генетических и транскрипционных сбоев, но и открывает путь к тестированию потенциальных терапевтических подходов. Возможность имитации ранних этапов развития и наблюдения за последствиями генетических манипуляций предоставляет уникальную платформу для изучения молекулярной патогенезы и индивидуальных особенностей заболеваний.
В целом, накопленные знания свидетельствуют о том, что многие кортикальные заболевания имеют свои корни в нарушениях работы нейронных стволовых клеток на ранних этапах индивидуального развития. Эффективное моделирование и картирование этих нарушений позволит не только расширить наше понимание болезней мозга, но и сделать шаг вперед в создании персонализированных стратегий профилактики и лечения. В ближайшем будущем ожидается, что благодаря интеграции крупномасштабных многоклеточных данных, улучшенной биоинформатической аналитике и инновационным экспериментальным подходам, будет возможным выявлять новые генетические маркеры риска, раскрывать патогенные механизмы на молекулярном уровне и разрабатывать целевые препараты с минимальными побочными эффектами. Такая трансформация существенно изменит подходы к диагностике и терапии нейроразвивающихся расстройств и кортикальных поражений, улучшая качество жизни миллионов людей.