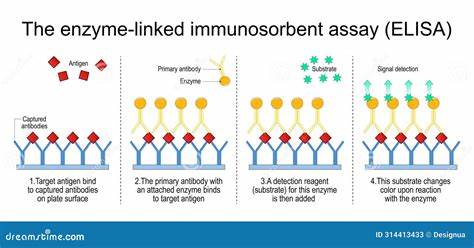
Иммуноферментный анализ, широко известный под аббревиатурой ELISA, представляет собой мощный и универсальный метод, используемый для обнаружения и количественного определения различных биологических веществ, таких как белки, пептиды, гормоны и антитела. Этот метод основан на специфическом взаимодействии между антигеном и антителом, что позволяет с большой точностью и чувствительностью идентифицировать искомые молекулы даже в сложных биологических образцах. ELISA занимает центральное место в биомедицинских исследованиях, диагностике заболеваний, контроле качества биофармацевтических препаратов и мониторинге иммунных ответов организма. Основополагающий принцип ELISA базируется на том, что один из компонентов иммунного взаимодействия – антиген или антитело – иммобилизируется на твердой поверхности, обычно на стенках микропланшета с множеством лунок. Образец, содержащий интересующее вещество, добавляется в лунки и связывается с фиксированным на поверхности компонентом.
Для визуализации и количественного измерения связывания используется фермент, конъюгированный с антителом, способный преобразовывать субстрат в окрашенный или светящийся продукт. Интенсивность сигнала пропорциональна концентрации анализируемого вещества. Современные методы ELISA включают несколько основных форматов, каждый из которых имеет свои особенности и области применения. Прямой ELISA заключается в использовании фермент-связанного первичного антитела, которое непосредственно связывается с антигеном на поверхности. Такой подход прост и быстр, но иногда уступает в чувствительности и специфичности.
Косвенный ELISA подразумевает связывание антигена с неконъюгированным первичным антителом, а затем добавление фермент-связанного вторичного антитела, что значительно усиливает сигнал и повышает чувствительность анализа. Сэндвич-ELISA, пожалуй, наиболее популярный и широко применяемый формат, особенно для количественного определения белков и других растворимых молекул. В этом методе антиген захватывается антителом, иммобилизованным на микропланшете, а затем определяется с помощью второго, так называемого детектирующего, антитела, связывающего другой эпитоп этого антигена. Такая двойная специфичность существенно снижает фоновые сигналы и повышает точность измерений. Конкурентный ELISA применяется тогда, когда невозможно использовать сэндвич формат, например, при анализе малых молекул или веществ с единичным эпитопом.
В этом случае наличие аналога вещества, меченного ферментом, создает конкуренцию с исследуемым антигеном за ограниченное количество антител. При увеличении концентрации исследуемого вещества сигнал уменьшается, что служит показателем концентрации анализируемого вещества в образце. Кроме традиционных форматов существует развитие специализированных протоколов, таких как ELISA для определения фосфорилированных форм белков. Фосфорилирование является ключевым механизмом регуляции функций белков и сигнализации внутри клетки, поэтому возможность количественно оценить именно фосфорилированный вариант имеет большое значение в исследованиях клеточной биологии и молекулярной медицины. Такие ELISA часто используют сэндвич формат, где захватывающее антитело связывает общий белок, а детектирующее – фосфорилированный эпитоп.
Отдельного внимания заслуживает инцеллюлярный ELISA (In-Cell ELISA), позволяющий напрямую измерять уровни белков внутри фиксированных и пермеабилизированных клеток, культивируемых в микропланшетах. Этот подход избавляет от необходимости выделения и очистки белка, позволяет проводить количественный анализ в условиях, максимально приближенных к физиологическим, и подходит для исследования внутриклеточных процессов, включая модификации белков и клеточные ответы на внешние стимулы. Техника проведения ELISA требует тщательной подготовки и внимания к деталям. Начинается процедура с покрытия микропланшета захватывающим антителом или антигеном. После инкубации происходит серия промывок для удаления несвязанных компонентов.
Для предотвращения неспецифических взаимодействий применяется блокировка поверхности с помощью белковых или других комплементарных блокирующих растворов. Далее образцы и стандарты добавляются в лунки и инкубируются для связывания с иммобилизованным компонентом. После удаления несвязанных веществ вводится детектирующее антитело, часто меченное ферментом или биотином, с последующим введением фермент-связанного чтения, например, стрептавидина-HRP. Окончательно добавляется субстрат фермента, вызывающий развитие окраски или свечения пропорционально количеству таргетного вещества. Результаты фиксируют с помощью спектрофотометра или специального читателя микропланшетов.
Для анализа результатов строится стандартная кривая, используя образцы с известной концентрацией анализируемого вещества. С помощью этой кривой вычисляют содержание исследуемых молекул в образцах. Выбор математической модели для аппроксимации данных зависит от характеристик конкретного анализа и параметров, включая линейный, логарифмический и четырехпараметрический логистический модели. Для обеспечения высокой точности и воспроизводимости результатов необходимо учитывать качество и специфику используемых антител и реактивов. Антитела должны быть тщательно подобраны и валидированы для целевого эпитопа.
Особенно важно это при работе с фосфорилированными белками и инцеллюлярными исследованиями, где специфичность может определять достоверность всей работы. Температурные условия и время инкубации играют важную роль в эффективности связывания и активности ферментов. Всегда рекомендуется строго придерживаться рекомендованных температурных режимов и продолжительности этапов. Точность пипетирования и аккуратность при проведении промывок влияет на уровень фоновых сигналов и возможность ошибочного чтения. В инцеллюлярных методах необходимо тщательно соблюдать технику, чтобы сохранить целостность клеточного слоя и обеспечить качественное проникновение антител через клетки.
Контрольные эксперименты с использованием контрольных образцов, пустых лунок и отрицательных контролей обязательны для корректной интерпретации результатов. Для инцеллюлярных ELISA рекомендуется иметь параллельные анализы общего количества белка или эталонных контрольных белков, что позволяет нормализовать результаты с учетом вариаций в количестве клеток и экспрессии. Оптимизация условий, таких как концентрация антител, время инкубации и выбор блокирующих растворов, может значительно повысить чувствительность и снизить фон. На практике это означает необходимость предварительного тестирования и калибровки методики для конкретного типа образцов и анализируемых веществ. Несмотря на относительно простую концепцию, ELISA продолжает развиваться и адаптироваться под новые задачи.