Малярия продолжает оставаться серьезной угрозой для здоровья миллионов людей во всем мире, ежегодно унося жизни сотен тысяч. Несмотря на прогресс в борьбе с паразитом, вызвавшим малярию, возбудителем Plasmodium, болезнь продолжает широко распространяться, особенно в странах с теплыми климатическими условиями. Традиционные методы профилактики и лечения постепенно сталкиваются с новыми вызовами, такими как устойчивость паразитов к лекарствам и насекомых к инсектицидам, что заставляет ученых искать альтернативные решения. Одним из самых перспективных направлений сегодня стала генная инженерия, а именно работа с генетическими вариантами комаров — переносчиками малярийного паразита, которые могут изменить способность насекомых вообще поддерживать цикл инфекции внутри себя. В центре внимания последних исследований оказался ген FREP1, кодирующий белок фибриноген-связанных рецепторов 1, играющий ключевую роль в процессе инфицирования комара малярийным паразитом.
В частности, открытие уникального природного аллеля FREP1Q стало настоящим прорывом, так как этот вариант гена препятствует распространению паразитов внутри комара и одновременно сохраняет его жизнеспособность и репродуктивные функции. Данный аллель, заменяющий аминокислоту лейцин на глутамин в 224-й позиции белка (L224Q), был тщательно изучен на генетическом уровне и в условиях лабораторной колонии Anopheles stephensi — одного из основных видов малярийных комаров в Азии. Экспериментальное внедрение этого аллеля показало впечатляющую устойчивость генетически модифицированных комаров к инфекциям Plasmodium falciparum и Plasmodium berghei, который используется как модельный паразит. Исследователи сумели создать «конгенные» штаммы, которые отличаются только одной аминокислотной заменой в FREP1, что позволяет уверенно связывать наблюдаемую устойчивость именно с этим изменением. Ключевым прорывом стало то, что данный аллель практически не влияет на жизнеспособность комаров.
Масштабные тесты по размеру тела, фертильности, продолжительности жизни и конкурентоспособности в популяциях не выявили существенных негативных последствий, что является критически важным аспектом для успешного внедрения и распространения защитного варианта среди природных комаровых популяций. Одно из главных ограничений традиционных генных модификаций комаров для борьбы с малярией заключалось в нежелательных побочных эффектов, когда нарушение функций важных белков сказывалось на жизнеспособности насекомых. Плюс к этому требовалась точная регуляция и синхронизация активности генов, связанных с борьбой против паразита, что не всегда достигалось при классических подходах с переносом образцов иммунных или антипаразитарных белков. В отличие от этого, изменение одной аминокислоты, как в случае с FREP1Q, сохраняет жизненно важные функции белка для комара, но эффективно блокирует возможность паразита преодолеть барьеры кишечного эпителия перед размножением. Однако создание устойчивого противомалярийного штамма комаров — только часть задачи.
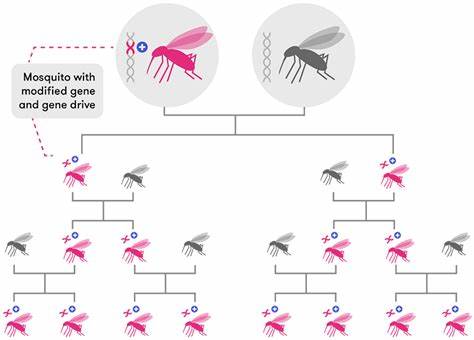
Ключевым моментом является обеспечение эффективного распространения данной генетической модификации в природных популяциях. Для этого была разработана инновационная система «ассоциированного аллельного драйва», в которой генетический элемент, несущий гены Cas9 и специфические направляющие РНК (gRNA), целенаправленно заменяет естественную версию гена FREP1L (предрасполагающую к инфекциям) на победоносный FREP1Q. Использование CRISPR/Cas9 технологии позволяет значительно превысить обычные пределы наследования генов. Вместо классических 50% вероятность получения конкретного аллеля от родителей может возрасти до 70-90%, а иногда и более, благодаря тому, что спаренный хромосомный локус с незащищённым аллелем подвергается специфической «замене» в ходе его репарации. Благодаря тесной взаимосвязи локуса и каталитического элемента, инженерное сочетание обеспечивает стабильный и эффективный процесс распространения необходимой передачи гена.
Многочисленные трёхпоколенные и многопоколенные опыты с популяциями показали, что частота защитного аллеля FREP1Q в контрольных условиях может расти с 25% до более чем 90% всего за десять поколений. При этом возникновение нежелательных мутаций, способных препятствовать эффективной работе системы, остаётся минимальным, а возникающие невырожденные поврежденные версии целевого гена подвергаются естественному отбору за счёт снижения приспособленности. Что особенно важно, насекомые, несущие модифицированную версию гена, сохраняют нормальную жизнеспособность и поведение, что избавляет от риска существенного снижения численности или изменения экосистемных функций. Такое «нейтральное в плане фитнеса» вмешательство значительно облегчает интеграцию генетических инноваций в естественные популяции комаров. Перенос технологии на различные виды малярийных комаров, таких как Anopheles gambiae — ключевой африканский переносчик — может кардинально повлиять на борьбу с малярией на континенте, где бремя заболевания особенно велико.
Кроме того, разработка локализованных стратегий — когда генная модификация распространяется лишь в узких географических участках — возможна за счёт точной настройки инструментов, базирующихся на отношении гомологии между генами донорской и принимающей хромосом. Помимо разработки новой технологии, учёные акцентируют внимание на важности этических аспектов, биобезопасности и необходимости комплексного подхода к изучению потенциальных экологических последствий. Ведь широкое внедрение генетических драйвов требует не только научного подтверждения эффективности, но и общественного диалога, нормативной оценки и международного сотрудничества. Современные математические модели, основанные на эмпирических данных, позволяют прогнозировать динамику распространения гена, вероятные побочные эффекты и оптимизировать стратегии развертывания. Они учитывают не только биологические, но и поведенческие и демографические параметры популяции комаров, что повышает точность и надёжность предсказаний.