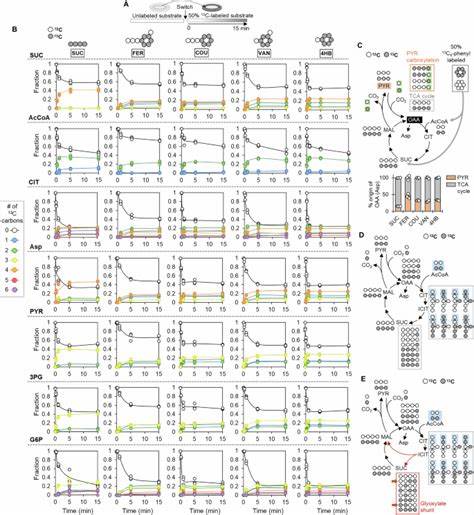
Лигнин - крупный структурный биополимер, который наряду с целлюлозой составляет основу растительной биомассы. Его уникальная сложная структура и химическая устойчивость вызывают значительные трудности в переработке, однако лигнин также представляет обширный возобновляемый источник ароматических соединений - фенольных кислот, способных служить сырьём для производства биохимикатов и биотоплива. Среди микроорганизмов, способных эффективно использовать лигнин и его производные, особое внимание уделяется бактериям рода Pseudomonas, в частности штамму Pseudomonas putida KT2440. Несмотря на его широкое применение в биотехнологии, до недавнего времени остаётся недостаточно ясно, каким образом этот организм согласует углеродный метаболизм с энергопроизводством и балансом ключевых кофакторов NADH и NADPH во время катаболизма фенольных субстратов. Новейшие исследования, опирающиеся на методы мультиомики, включая протеомику, метаболомику и 13С-флюсомику, раскрывают детальную картину этого процесса, давая базу для дальнейшего метаболического инженерирования этой бактерии с целью максимизации эффективности лигнинвалоризации.
Pseudomonas putida KT2440 способна приспособиться к работе с различными фенольными кислотами, включая феруловую, паракумаровую, ваниловую и 4-гидроксибензойную кислоты, которые образуются при химическом деполимеризационном разрушении лигнина. Эти соединения метаболизируются через ряд специализированных путей, где промежуточным веществом является протокатекуловая кислота (PCA). В ходе превращения субстратов в PCA происходит последовательный перенос углеродного скелета в центральный метаболизм - цикл трикарбоновых кислот (ЦТК), сопровождающийся выработкой коферментов, таких как NADH, NADPH и аденозинтрифосфат (АТФ), необходимых для энергетических и восстановительных нужд клетки. Одной из важных особенностей метаболизма P. putida является скоординированная регуляция экспрессии и активности белков, ответственных как за транспорт фенольных кислот внутрь клетки, так и за катаболизм каждого из этих соединений.
При росте на феруловой и паракумаровой кислотах наблюдается огромное увеличение количества транспортёров и катаболических ферментов - порой более чем в 100 раз относительно роста на сукцинате. Особенно заметны повышения в уровне ферулоил- and паракумароил-CoA синтетаз, ванилатоксиметилаз (VanAB), а также ферментов, катализирующих превращение протокатекуловой кислоты через β-кетoadипатный путь до ацетил-КоА и сукцината. Помимо этого, повышается содержание белков, входящих в гликоксилатный шунт, который играет ключевую роль в сохранении и перераспределении углеродных потоков, позволяя эффективно перерабатывать ароматические соединения, несмотря на декарбоксилирование, характерное для классического ЦТК. Несмотря на возрастающий катаболизм фенольных соединений, P. putida умеет поддерживать высокий энергетический статус, что подтверждается повышенным уровнем АТФ и значительной избыточностью NAD(P)H по сравнению с ростом на неароматических субстратах.
Высокий энергетический заряд обеспечивается за счёт перераспределения потоков через ключевые анемплеротические и катаплеротические ферменты, где основным механизмом является активизация пируваткарбоксилазы, способствующей пополнению оксалоацетата, и маликовой кислотыдегидрогеназы, производящей NADPH. Вместе с работой изоцитратлиазы гликоксилатного шунта, эти процессы позволяют поддерживать баланс между энергетической эффективностью и необходимостью вырабатывать восстановительные эквиваленты для биосинтетических и стрессовых ответов. Ключевым моментом в регулировании метаболизма при использовании фенольных субстратов является преодоление так называемых "узких мест" - этапов пути, на которых происходит накопление определённых метаболитов, указывающее на ограничение скорости реакции. Эти узкие места были идентифицированы на основе внутриклеточного накопления ванилина, 4-гидроксибензальдегида и самого протокатекулата. Генетические модификации, направленные на повышенную экспрессию ферментов VanAB, Vdh, PobA и PcaHG, позволили частично снять эти ограничения, однако при этом наблюдалось снижение энергетического заряда клетки, указывающее на энергетический стресс, возможно связанный с затратами на синтез белков и сдвигами метаболического баланса.
Данные свидетельствуют о том, что при инженерных улучшениях необходимо учитывать не только скорость синтеза ключевых ферментов, но и способность клетки поддерживать энергетический гомеостаз. Совместный анализ 13С-метаболической флюсомики и протеомных данных помогает детализировать картину метаболической перестройки. Результаты показывают, что при росте на фенольных соединениях резко возрастает поток через пируваткарбоксилазу, что приводит к заметному увеличению анемплеротического пополнения оксалоацетата, а путь гликоксилатного шунта обеспечивает катаплеротическую выгрузку углеродных потоков через маликовую кислотудегидрогеназу. Такая организация оптимизирует распределение углеродных скелетов, баланс между потребностью в восстановительных коферментах и высвобождение энергии в виде АТФ. При этом изоформы ферментов проявляют избирательность к NADH или NADPH, что оказывает влияние на общий энергетический статус и потребности метаболизма.
Хорошо согласуется представленная модель с результатами экспериментов, где были измерены повышение уровня АТФ и реакция клеток на избыточное производство NAD(P)H. Обеспечение достаточного количества NADPH особенно важно для поддержания окислительно-восстановительного баланса и биосинтеза, а NADH служит главным субстратом для ресфосфорилирования и генерации АТФ. Увеличенная доля гликоксилатного пути в цикле трикарбоновых кислот дополнительно предотвращает потерю углерода, что является критически важным при работе с ароматическими соединениями, где сохранять углерод максимальной полноты особенно актуально. Метаболическая пластичность P. putida KT2440 позволяет ей не только прочувствовать сигналы изменений в окружающей среде, но и адаптировать метаболические потоки так, чтобы оптимизировать использование доступных ресурсов и снизить энергетический стресс.
Такой баланс достигается гибкой регуляцией ферментативных уровней, а также разветвлённой системой переноса электронов и производства энергии. Результаты исследований дают ключевые знания для разработки более продуктивных штаммов через модификацию узлов обмена и коферментного баланса, что позволит повысить эффективность биотрансформации и биоконверсии лигнинсодержащих субстратов. Перспективы включают изучение соиспользования множества субстратов - фенольных кислот, сахаров и алкановых кислот - что характерно для сложных древесных гидролизатов. Понимание того, как данные потоки координируются в клетке, позволит создавать устойчивые и высокопроизводительные биотехнологические процессы. Кроме того, методы, применённые для декодирования метаболизма P.
putida, могут быть адаптированы для других бактерий с потенциалом к лигнинвалоризации, способствуя развитию углеродно-энергетического гедонизма в биоинженерии. В конечном счёте глубокое изучение углеродного и энергетического метаболизма Pseudomonas putida формирует основу для преобразования лигнина из трудноутилизируемого отхода в ценный ресурс. Это открывает новые возможности для устойчевого развития биопроизводства и зелёной химии, ключевых секторов современной биоэкономики на пути к переходу на возобновляемые источники сырья и снижению нагрузки на окружающую среду. .