Метформин, являющийся одним из самых распространённых препаратов для лечения сахарного диабета 2 типа, используется в клинической практике уже более шестидесяти лет. Несмотря на его широкую популярность и эффективное снижение уровня сахара в крови, точные механизмы действия метформина до сих пор остаются предметом активных исследований и споров. Традиционно считалось, что метформин оказывает своё терапевтическое воздействие преимущественно за счет уменьшения продукции глюкозы в печени и влияния на кишечник. Однако свежие исследования раскрывают важную роль мозга, а именно белка Rap1, в обеспечении антидиабетического эффекта препарата даже при низких, клинически релевантных дозах, создавая новую парадигму понимания его действия. Углубленное изучение Rap1 в головном мозге проливает свет на сложные нейронные механизмы, которые регулируют сахарный обмен и чувствительность к инсулину.
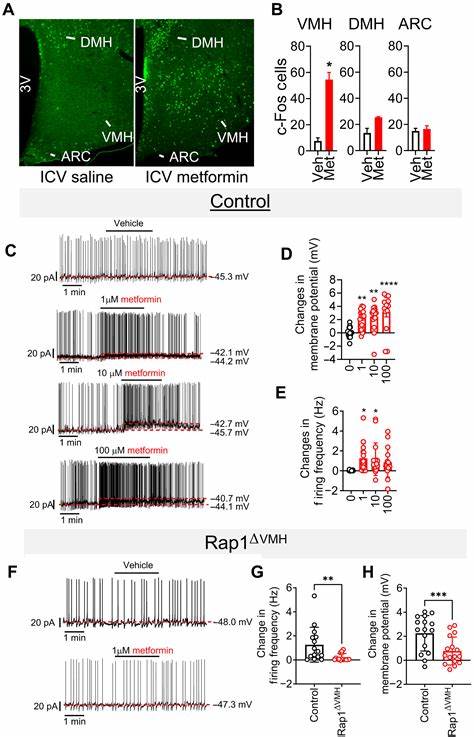
Rap1 – это небольшой белок, относящийся к классу гуанозинтрифосфатаз, который регулирует множество клеточных процессов, включая передачу сигналов. Особое внимание уделяется его роли в вентромедиальном гипоталамусе (VMH) – центре мозга, который отвечает за регуляцию энергетического обмена и гомеостаза глюкозы. В исследованиях на мышах с генерализованным удалением Rap1 в нейронах переднего мозга выявлена устойчивость к снижению уровня глюкозы при лечении низкими дозами метформина, в то время как чувствительность к другим антидиабетическим препаратам сохраняется. Это открытие свидетельствует о точечном и специфическом влиянии метформина через нейрональный Rap1, что не наблюдается при применении альтернативных терапевтических средств. Централизованное введение метформина непосредственно в мозг показало, что препарат способен снижать гликемию без каких-либо значимых эффектов на аппетит или массу тела, что указывает на прямое действие в центральной нервной системе.
Этот эффект сопровождается подавлением активности Rap1 в гипоталамусе, что подтверждает наличие механизма ингибирования Rap1 белка метформином, ведущего к улучшению обмена глюкозы в организме. Дополнительные эксперименты с мышами, у которых Rap1 искусственно активирован в нейронах, продемонстрировали отмену эффекта метформина: такие животные сохраняют высокий уровень глюкозы и не реагируют на лечение, подтверждая ключевую роль Rap1 в указанном процессе. Более детальный анализ выявил, что метформин вызывает активацию определенной группы нейронов VMH, особенно тех, которые содержат стероидный фактор-1 (SF1). Электрофизиологические исследования показали, что метформин деполяризует эти SF1-нейроны, повышая их активность, но только при наличии функционирующего Rap1. При удалении Rap1 ответ нейронов на метформин существенно снижается, что указывает на важность белка для непосредственного нейронального реагирования на препарат.
Эти открытия позволяют предположить, что VMH SF1-нейроны, регулируемые Rap1, служат важным центральным узлом для обеспечения гликемического контроля метформином. Потенциально именно эти клетки выполняют функцию моста между воздействием препарата и системной регуляцией уровня сахара в крови. Важно отметить, что эффект низких доз метформина отличается от действия высоких супрафармакологических доз, которые могут обходить значимость нервного Rap1 и задействуют классические периферические пути, такие как ингибирование различных ферментов печени. Низкие концентрации препарата способны проникать через гематоэнцефалический барьер и непосредственно влиять на VMH, что подчеркивает чувствительность этой области и роль центральной регуляции гомеостаза. Концепция нейронального управления энергетическим обменом и гликемией укрепляется результатами, подтверждающими, что помимо печени и кишечника мозг играет ключевую роль в адекватном ответе на метформин, особенно при терапевтических дозах.
Кроме того, выявленное взаимодействие метформина с Rap1 указывает на возможность новых терапевтических мишеней для улучшения контроля диабета путем модуляции нейрональных белков и сигналов. Эти данные открывают перспективы для разработки новых препаратов, направленных на мозговые механизмы, а также для оптимизации дозировки метформина для максимального эффекта с минимальными побочными действиями. Раскрытие механизма снижения активности Rap1 по действием метформина также поднимает вопрос о взаимодействии с другими центрами регуляции в нервной системе и потенциале координированного контроля глюкозы и энергетического баланса. Более широкое понимание таких нейрональных сигналов поможет не только усовершенствовать лечение диабета 2 типа, но и пролить свет на общие механизмы метаболических заболеваний. Несмотря на значимость открытий, остаются вопросы касательно точных молекулярных путей, ведущих от ингибирования Rap1 до системного улучшения параметров обмена веществ.
Предполагается, что в дальнейшем внимание следует уделять изучению взаимодействия Rap1 с другими сигнальными белками, таких как EPAC2, и изучению роли лизосомальных комплексов, участвующих в активации AMPK, известного метаболического регулятора. Исследования на людях также необходимы, чтобы подтвердить значимость центрального Rap1 в ответе на метформин и оценить потенциальные вариации в клинической практике. В итоге, понимание, что низкие терапевтические дозы метформина требуют функционирования Rap1 в мозге для обеспечения антидиабетического эффекта, меняет стратегию подхода к лечению сахарного диабета 2 типа и расширяет область потенциальных исследований. Такое открытие соединяет нейронауку и эндокринологию, способствуя созданию интегративных методов терапии и управления заболеванием, с надеждой на улучшение качества жизни миллионов пациентов во всем мире.