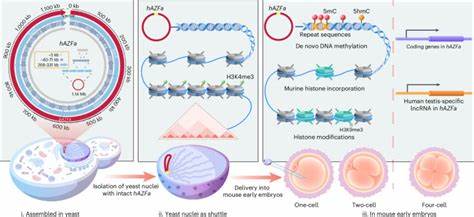
В последние годы биология развилась настолько, что синтез и сборка целых мегабазных участков человеческой ДНК выходят из области фантастики в реальную практическую науку. Одним из важнейших достижений стало создание и доставка синтетической мегабазовой человеческой ДНК в эмбрионы мышей, что предоставляет уникальную платформу для детального изучения механизмов эпигенетического регулирования и транскрипционной активности с нуля. Открытия в этой области не только усиливают наше понимание функционирования человеческого генома, но и предлагают новые подходы для модификации и дизайна геномов с медицинскими и биотехнологическими целями.\n\nТрадиционно изучение эпигенетики осложняется тем, что в естественных хромосомах уже присутствуют и наследуются эпигенетические метки — такие как метилирование ДНК или модификации гистонов. Это затрудняет исследование фундаментальных принципов установления этих меток и их влияния на регуляцию генов.
Разработка технологии SynNICE позволила обходить эту проблему, предлагая метод химического синтеза, сборки и целевого переноса мегабазовых фрагментов ДНК с полностью «наивным» эпигенетическим состоянием, то есть лишённым предварительно установленных модификаций.\n\nКлючевой эксперимент с регионом AZFa длиной 1,14 мегабазы человеческой Y-хромосомы показал, что после доставки этого синтетического сегмента в одноклеточные эмбрионы мышей начинается постепенное взаимодействие с молекулами хозяина. В частности, наблюдается замена исходного дрожжевого нуклеосомного каркаса на мышиные гистоны и установление специфического паттерна ДНК-метилирования. Этот процесс зарождается уже на стадии одной клетки и демонстрирует специфичное накопление метилированных цитозинов преимущественно в повторяющихся областях синтетического сегмента. Это важное наблюдение, так как метилирование репетитивных элементов известно как один из ключевых механизмов защиты генома и регуляции активности генов.
\n\nИнновационной чертой метода является использование дрожжевых клеток для пошаговой сборки большого и высокоповторяющегося участка человеческой ДНК. В отличие от кишечной палочки Escherichia coli, которая неустойчива для ДНК свыше 500 килобаз, дрожжи предоставляют среду, позволяющую комбинировать сотни мелких синтезированных фрагментов в единую мегабазную цепь. Это стало возможным благодаря стратегии комбинаторной рекомбинации с большими областями гомологии, а также с применением технологии CRISPR/Cas9 для точного и эффективного объединения субконструктов. Полученные хромосомные комплексы сохранялись в дрожжах на протяжении многих поколений, не вызывая заметных изменений в их уровне транскрипции и структуре.\n\nСледующий критический этап — выделение ядер дрожжей, содержащих эти мегабазовые конструкторы.
Технология NICE (Nucleus Isolation for Chromosome Extraction) обеспечивает щадящее отделение и сохранение структуры хромосом внутри изолированных ядер, минимизируя деградацию ДНК и сохраняя основную пространственную организацию хроматина. Изолированные ядра можно хранить при низких температурах, не теряя функциональности и целостности структуры. Это существенно облегчает последующий перенос и манипуляции с ними.\n\nДля доставки в клетки млекопитающих была выбрана микроманипуляция с введением изолированных дрожжевых ядер в цитоплазму метафазных ооцитов мыши. В таких условиях был зафиксирован быстрый процесс замещения дрожжевого хроматина на мышиный, что подтверждается быстрой инкорпорацией мышиных гистонов и обнаружением эпигенетических меток, характерных для млекопитающих.
Более того, было отмечено появление DNA-метилирования, демонстрирующего немаловажный феномен первичной установки эпигенетических паттернов на полностью «чистой» ДНК. Это доказывает, что извне введённый синтетический геном может подвергаться сложному эпигенетическому ремоделированию, адаптируясь к хост-окружению.\n\nФункционально синтетический регион AZFa начинал транскрибироваться примерно с четырёхклеточной стадии эмбриона, что совпадает с периодом активизации генома в раннем развитии и согласуется с естественным графиком экспрессии его аналогов. Кроме того, ингибирование DNA-метилтрансфераз и ферментов, отвечающих за деметилирование, вызывает вариации в сроках и уровнях транскрипции, доказывая высокую степень регуляции на эпигенетическом уровне.\n\nОдним из интересных открытий стала особенность метилирования синтетического участка, при которой DNA-метилирование претерпевает целенаправленное накопление именно в повторяющихся элементах и межгенных областях, несмотря на то что в этих условиях не наблюдается усиленного наложения репрессивных гистоновых меток, таких как H3K9me3.
Это поднимает вопрос о механизмах, распознающих повторяющиеся последовательности и направляющих де ново метилирование. Предполагается участие факторов ДНК-связывающих белков и длинных некодирующих РНК, что открывает новые перспективы для глубокого функционального анализа.\n\nУспешная сборка и доставка мегабазовых конструкций человеческой ДНК демонстрирует потенциал технологий синтетической геномики для создания полноценного искусственного человеческого генома или отдельных крупных его участков в экспериментальных моделях. Это особенно актуально для исследований наследственных заболеваний, которые трудно моделировать классическими методами, а также для создания новых платформ для изучения молекулярных механизмов регуляции транскрипции, эпигенетической реорганизации и молекулярной физиологии.\n\nСовременные синтетические методы позволяют не только собирать большие конструкции, но и модифицировать их по желанию, внося замены в кодирующие и регуляторные сегменты, что открывает дорогу к экспериментальному пониманию роли отдельных последовательностей в формировании геномной стабильности и экспрессии.
Доставка таких конструкций в живую эмбриональную систему позволяет исследовать динамику изменений этих параметров в ходе развития, описать закономерности адаптации, и использовать эти знания для создания новых инструментов в регенеративной медицине и генной терапии.\n\nПерспективы развития техники SynNICE включают внедрение многократной доставки различных мегабазовых конструкций одновременно, возможные усовершенствования механизмов инокуляции и перенос в другие типы клеток. Кроме того, внедрение в инженерный процесс искусственных хромосом с элиминацией дрожжевых хромосом позволит повысить специфичность и стабильность конструкций.\n\nИзучение синтетической ДНК в эмбриональных клетках дает новые знания о начальных стадиях эпигенетического ремоделирования, которые трудно наблюдать в естественных организмах, где геномы уже несут наследственные метки. Данный подход служит уникальной платформой для экспериментов, которые в будущем могут помочь понять фундаментальные принципы биологии развития, коррелировать их с заболеваниями и работать над новыми методами вмешательства.
\n\nТаким образом, внедрение и масштабирование технологий де ново сборки и доставки мегабазовой синтетической человеческой ДНК открывает новые горизонты в науке и медицине. Совмещение химического синтеза, генной инженерии, молекулярной биологии и эмбриологии формирует уникальный симбиоз методов, способных перевернуть представления о функционировании генома на всех уровнях организации живых систем.