Старение – естественный процесс, сопровождающийся постепенным ухудшением функций различных систем организма. Одной из ключевых причин старения является снижение эффективности стволовых клеток, которые обеспечивают обновление тканей и их восстановление после повреждений. В последние годы ученые уделяют особое внимание мезенхимальным стволовым клеткам (МСК), способным дифференцироваться в различные типы тканей и модулировать иммунные ответы. Однако с возрастом эти клетки теряют свои регенеративные способности и склонны к старению сами. В связи с этим возникла идея создания клеток, устойчивых к старению, которые способны противостоять возрастным изменениям и восстановить функцию тканей, утраченную с годами.
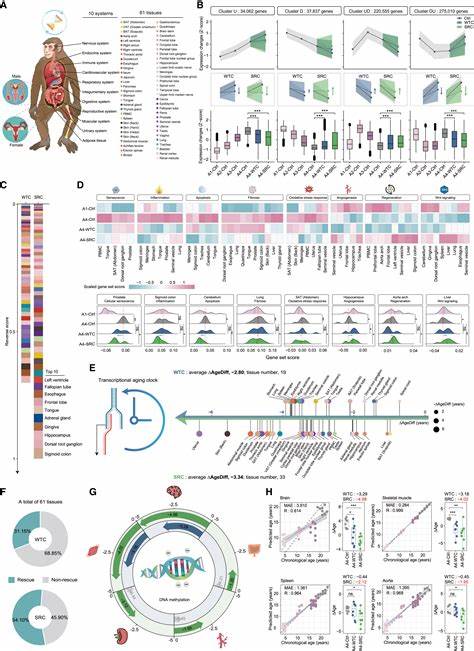
Недавние исследования, проведённые на приматах, показали впечатляющие результаты в применении генетически модифицированных человеческих мезенхимальных прогениторных клеток, называемых сенесцентностойкими клетками (SRC - senescence-resistant cells). Эти клетки получают особую генетическую адаптацию, благодаря которой они устойчивы к процессам клеточного старения, таким как накопление ДНК-повреждений, воспаление и деградация тканей. В ходе длительного 44-недельного эксперимента SRC-ы вводились внутривенно старым макакам, что позволило оценить системное влияние таких клеток на организм. Результаты исследования доказали, что обработка SRC значительно замедляет и даже частично обращает в обратную сторону многие биомаркеры старения. В частности, наблюдалось снижение количества стареющих клеток в различных тканях, уменьшение хронического воспаления, характерного для возрастных процессов, а также улучшение структуры тканей, включая мозг и репродуктивные органы.
Улучшение когнитивных функций животного свидетельствует о том, что SRC способны не только замедлять дегенеративные изменения, но и восстанавливать нейроархитектуру, что особенно важно для профилактики возрастных нейродегенеративных заболеваний. Основой эффективного воздействия SRC считается выделяемый ими экзосомный груз – маленькие везикулы, наполненные биологически активными молекулами, которые принимают участие в межклеточной коммуникации и регуляции. Эти экзосомы способствуют улучшению клеточного обмена веществ, стимулируют рост здоровых клеток и противодействуют развитию клеточного старения. Таким образом, экзосомы SRC выступают как своеобразный «транспорт» молекулярной поддержки, обеспечивая распространение антивозрастного сигнала по всему организму. Генетическое укрепление SRC, как правило, связано с усилением функции гена FOXO3, который играет центральную роль в регуляции процессов старения и продолжительности жизни у млекопитающих.
FOXO3 отвечает за защиту клеток от окислительного стресса, регуляцию репарации ДНК и поддержание клеточного гомеостаза. Внесение модификаций в этот ген позволяет сделать мезенхимальные прогениторные клетки более устойчивыми к стрессам и ускоренному старению, что обеспечивает их долговременное функционирование в организме. В разных исследованиях влияние FOXO3 связывали с продлением жизни и замедлением возрастных заболеваний, что делает его одним из ключевых таргетов в генетической терапии старения. Использование старческих животных, особенно приматов, в качестве модели для тестирования SRC является большим шагом вперед, так как приматы обладают биологическими особенностями, максимально приближенными к человеку. Подобные эксперименты позволяют точно оценить безопасность, эффективность и потенциальное воздействие терапии на сложные физиологические системы и дают надежду на перспективу перехода к клиническому применению у людей.
Кроме улучшения когнитивных функций, SRC продемонстрировали влияние на репродуктивную систему, существенно улучшая показатели и замедляя возрастные изменения в органах размножения. Это открывает новые возможности в терапии возрастного снижения фертильности и в борьбе с преждевременным старением репродуктивной системы, особенно актуальными для людей в современном обществе, где возраст первого ребенка зачастую значительно повышается. Важное достоинство SRC состоит в том, что они вводятся системно и не вызывают выраженных побочных эффектов, что нередко является проблемой при использовании традиционных препаратов или менее специализированных клеточных терапий. Это связано со способностью таких клеток адаптироваться к среде и выполнять регулирующие функции без инициирования нежелательных иммунных реакций. Текущие исследования также подчеркивают важность экзосом как основы для перспектив клеточной терапии без необходимости переносить сами клетки – так называемую бесклеточную терапию.
Это может упростить производство лечебных препаратов, снизить риски и расширить доступность методов регенерации для широкого круга пациентов. Ключевым вызовом при разработке таких клеточных технологий остается обеспечение долговременной и безопасной интеграции SRC в организм, а также подтверждение их положительного влияния на множество систем, от нервной до иммунной и эндокринной. Эксперименты с приматами уже показали, что такие надежды оправданы, но требуется дальнейшее изучение механизмов, а также долгосрочное наблюдение. Перспективы развития направлений, связанных с генетической модификацией клеток и их применением для борьбы со старением, многочисленны и обещают революционные изменения в сфере геронтологии и медицины. Возможно, в обозримом будущем появится возможность создавать персонализированные терапии, направленные на омоложение конкретных органов или систем, а также на общее повышение качества жизни и продление ее продолжительности без серьезных побочных эффектов.
Таким образом, сенесцентностойкие человеческие мезенхимальные прогениторные клетки представляют собой инновационный инструмент для противодействия старению, открывая перспективы нового поколения регенеративных и генетических технологий. Их успешное внедрение в клиническую практику может стать революцией в медицине долголетия, обеспечив людям возможность сохранить здоровье, ясность ума и физическую активность на долгое время.

![Making a computer out of marbles and wood [video]](/images/628A4271-6CE8-408A-A292-FB1D03EF2B15)