Острая миелоидная лейкемия (ОМЛ) является одним из самых сложных и неоднородных по клиническому течению гематологических злокачественных заболеваний. На сегодняшний день мутации в гене NPM1 (Nucleophosmin 1) считаются ключевыми биомаркерами, определяющими особый подтип ОМЛ, присутствующий примерно у 30% взрослых пациентов. Эта мутация придает заболеванию характерные биологические особенности, сказывающиеся на клинической картине и ответе на терапию. Несмотря на относительную благоприятность прогноза по сравнению с другими формами ОМЛ, существует значительная гетерогенность исходов, что обусловлено наличием сопутствующих молекулярных изменений и клинических параметров. Последние исследования позволяют углубить понимание факторов, влияющих на выживаемость и эффективность лечения пациентов с NPM1-мутациями.
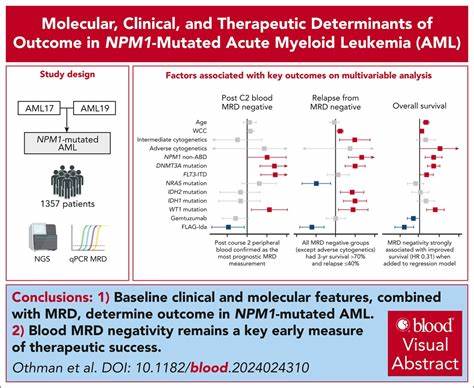
В одной из последних публикаций в специализированном журнале Blood описан анализ данных 1357 пациентов с NPM1-мутациями, проходивших интенсивную терапию по протоколам AML 17 и AML 19. Этот массив данных является крупнейшим на сегодняшний день в изучении данной субпопуляции пациентов с ОМЛ и позволяет выявить значимые молекулярные и клинические детерминанты эффективности лечения. В молекулярном профиле данной когорты пациентов были обнаружены частые сопутствующие мутации в генах FLT3 (особенно FLT3-ITD), DNMT3A, PTPN11, NRAS, TET2, IDH1, IDH2, и WT1. Высокая частота мутаций FLT3, достигающая 57%, особенно выделяется благодаря своему влиянию на клинический исход. FLT3-ITD (интернал дупликация тирозинкиназного домена) находится в 40% случаев и ассоциируется с более агрессивным течением болезни и худшим общим выживанием.
Использование современных методов молекулярного мониторинга минимальной остаточной болезни (MRD) стало важным инструментом в прогнозировании и адаптации терапии. MRD-отрицательность после курсов индукционной терапии является мощным прогностическим фактором, коррелирующим с улучшенным выживанием и сниженным риском рецидива. Анализ показывает, что мутации в DNMT3A и WT1, а также не-ABD (non-ABD) варианты мутаций NPM1 ассоциированы с увеличенной вероятностью положительного MRD статуса. С другой стороны, применение интенсивных режимов химиотерапии, таких как FLAG-Ida, способствует достижению отрицательного MRD, что подкрепляет стратегию более агрессивного лечения в определённых группах пациентов. Помимо молекулярных особенностей, клинические характеристики, такие как возраст пациента, общее состояние и специфические параметры заболевания, существенно влияют на выбор терапии и прогноз.
В рамках исследования учитывались данные о лечении и наблюдении пациентов, что позволило выявить статистически значимые показатели, влияющие на общий исход. Прогностически неблагоприятными мутациями, кроме FLT3-ITD, были признаны DNMT3A и WT1, а также характер мутаций NPM1, относящийся к категории non-ABD. Эти мутации в равной степени направляют риск рецидива и сокращают общую выживаемость, что подчеркивает необходимость комплексного генетического тестирования и индивидуального подхода к подбору терапии. Самым мощным предиктором выживаемости оказалась молекулярная MRD-отрицательность в периферической крови после второго цикла лечения. Это утверждение подтверждается мультивариабельным анализом, в котором MRD-статус превалировал над другими факторами, предлагая его в качестве ключевого маркера для оценки эффективности терапии и направления клинических решений.
Широкое применение высокоточных методов секвенирования и комплексной молекулярной диагностики уже реализуется в клинической практике. Специализированные лаборатории, такие как Мюнхенская лаборатория лейкемии (MLL), предоставляют профильные генетические тесты, включающие все релевантные гены с целью оптимизации терапии. Это обеспечивает индивидуализацию лечебных протоколов, повышая шансы на успешный исход и снижая риск ненужной токсичности. На фоне общего прогресса в лечении ОМЛ с мутациями NPM1 растет интерес к разработке таргетных препаратов и новых комбинационных терапий. Ингибиторы FLT3, эпигенетические регуляторы и иммуномодуляторы становятся объектом многочисленных клинических испытаний.
Уже сейчас в интеграцию с классическими интенсивными режимами лечения включаются инновационные подходы, что способствует улучшению результатов, особенно в группах с неблагоприятным молекулярным профилем. Дальнейшая работа направлена на более четкую стратификацию пациентов по риску и определение оптимальных схем терапии с учётом генетических мутаций, клинических характеристик и мониторинга минимальной остаточной болезни. В этой связи расширение баз данных и внедрение технологий больших данных играют ключевую роль, позволяя анализировать затрагивающие множество факторов взаимосвязи и предсказывать клинические исходы с большей точностью. Таким образом, изучение молекулярных, клинических и терапевтических факторов в контексте NPM1-мутаций при острой миелоидной лейкемии открывает новые горизонты для персонализированной медицины и улучшения качества жизни пациентов. Комплексный подход, включающий передовую молекулярную диагностику, мониторинг MRD и адаптивную терапию, уже становится новым стандартом в лечении этого заболевания.
Продолжение исследований и обмен клиническими данными позволят расширить арсенал терапевтических возможностей и повысить эффективность лечения ОМЛ в целом.