Мелкоклеточный рак легких (МРЛ) является одной из самых агрессивных форм рака, характеризующейся быстрым ростом, ранним метастазированием и высокой степенью смертности. Несмотря на достижения в терапии, средняя продолжительность жизни пациентов после постановки диагноза не превышает одного года. Недавние исследовательские данные внезапно раскрыли необычный аспект биологии МРЛ - способность опухолевых клеток формировать функциональные синапсы с нейронами. Это открытие связывает нейрональные взаимодействия с механизмами роста и развития опухоли и может стать ключом к новым стратегиям лечения. До недавнего времени взаимодействие между нервной системой и внеклеточными опухолями оставалось недостаточно изученным.
Хотя в опухолях центральной нервной системы, таких как глиомы, уже установлено образование синапсов с нейронами, возможность таких контактов в периферических опухолях была под вопросом. Однако исследования на мышиных моделях и анализ геномных данных пациентов с МРЛ подтвердили наличие мутаций и изменений экспрессии генов, связанных с синаптической передачей и нейрональными функциями. Генетические исследования выявили мутации и транспозонные вставки в ключевых синаптических генах, включая NRXN1, NLGN1, DCC и RELN, что указывает на вовлеченность этих белков в патогенез МРЛ. Кроме того, анализ транскриптома показал высокую экспрессию генов, связанных с глутаматергической и ГАМКергической передачей, что характерно для нейрональных клеток. Эти особенности связываются с фенотипом опухолевых клеток, напоминающим нейроэндокринные клетки легкого, которые считаются клетками-источниками МРЛ.
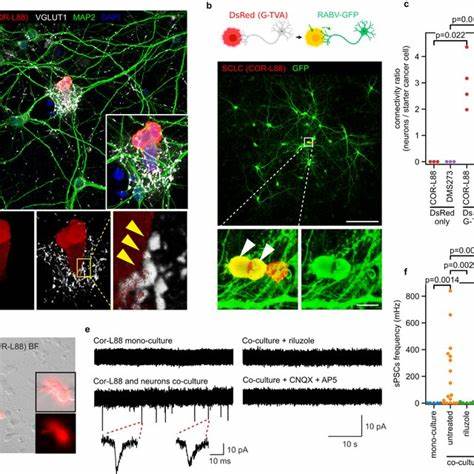
Ключевое значение имеют наблюдения функциональных синапсов между нейронами и МРЛ-клетками как в культурах клеток, так и на тканевом уровне у животных и человека. Использование конфокальной и сверхразрешающей микроскопии позволило визуализировать на клеточном и субклеточном уровнях контакты, включающие пред- и постсинаптические маркеры, такие как VGluT1, HOMER1 и Bassoon. Электрофизиологические исследования подтвердили наличие синаптической передачи: опухолевые клетки получают глутаматергические и ГАМКергические сигналы от нейронов, что демонстрирует их функциональную интеграцию в нейрональные сети. Формирование синапсов между нейронами и опухолевыми клетками имеет непосредственное влияние на биологию рака. Ко-культура МРЛ-клеток с нейронами способствует увеличению скорости пролиферации опухолевых клеток.
Этот эффект снижается при блокаде нейрональной активности, включающей ингибиторы глутаматных рецепторов и блокаторы натриевых каналов, что свидетельствует о значимости синаптической передачи для роста опухоли. Нейсом смещает акцент на исследование глутаматергической системы в МРЛ. Глутамат как основной возбудительный нейротрансмиттер мозга обнаружен также в микросреде опухоли, где он стимулирует рецепторы NMDA и метаботропные глутаматные рецепторы на опухолевых клетках, способствуя их выживанию и делению. Среди нескольких глутаматных рецепторов, связанных с МРЛ, особый интерес представляет GRM8 - ингибирующий метаботропный рецептор глутамата, функцию которого подтверждают мутации и экспрессия в опухолевых клетках. Разработаны и протестированы в доклинических условиях препараты, направленные на блокаду глутаматергических путей.
Агонисты GRM8 и ингибиторы выделения глутамата, такие как DCPG и ралузол, проявили способность замедлять рост опухоли и продлевать выживаемость в моделях МРЛ у мышей. Особенно эффективным оказалось сочетание ингибиторов глутаматергической передачи с традиционной химиотерапией, что даёт повод рассматривать эти подходы как перспективную терапевтическую стратегию для пациентов. Эти результаты имеют важные клинические и научные последствия. Они открывают новую парадигму в понимании взаимодействия опухолей с нервной системой, демонстрируя, что раковые клетки могут не только использовать нейрональные сигналы для собственного роста, но и напрямую формировать синапсы, интегрируясь в нервные сети. Такой феномен ранее считался уникальным для опухолей головного и спинного мозга.
Таким образом, синаптические контакты между нейронами и МРЛ представляют собой не просто биологическую особенность, но и потенциальную мишень для терапии. В будущем разработка средств, способных прервать или модифицировать эти взаимодействия, может значительно улучшить прогноз при МРЛ. Несмотря на значимость открытий, остаётся множество вопросов, требующих дальнейшего изучения. В частности, нужно понять, насколько широко распространена эта синаптическая связь между нейронами и опухолями других органов, а также определить молекулярные механизмы образования и регуляции синапсов в опухоли. Важно исследовать, какие типы нейронов преимущественно вовлечены в такие взаимодействия и как это влияет на распространение и метастазирование опухоли.
Также требуется разработка клинических испытаний для оценки эффективности антиглутаматергических препаратов у пациентов с МРЛ. Возможна необходимость персонализации терапии в зависимости от молекулярного подтипа опухоли, учитывая гетерогенность МРЛ и различия в уровне экспрессии синаптических генов. Кроме того, важно учитывать влияние нейрональных взаимодействий на иммунную среду опухоли и чувствительность к иммунотерапии, что может раскрыть новые сочетанные подходы лечения. В целом, выявление функциональных синапсов между нейронами и мелкоклеточным раком легких расширяет наши представления о биологии рака и нейроонкологии. Этот новый взгляд объединяет две ранее разрозненные области медицины - неврологию и онкологию - и формирует основу для инновационных подходов в борьбе с одним из самых коварных видов рака.
.




![Are We There Yet? Future of C++ Software Development – Sean Parent – C++Now 2025 [video]](/images/5798F6AA-A8E8-43CA-A5D7-7B3615B624FD)


