Болезнь Альцгеймера является одной из самых распространённых и разрушительных нейродегенеративных заболеваний, влияющих на когнитивные функции и память миллионов людей по всему миру. Несмотря на активные исследования, причины её возникновения и развитие патологических процессов остаются сложными и многообразными. Одной из ключевых областей современных исследований являются генетические факторы, способствующие риску заболевания. Научная группа из Массачусетского технологического института (MIT) недавно сделала важный шаг в понимании роли редких вариантов гена ABCA7 в развитии болезни Альцгеймера. Их открытие проливает свет на новые механизмы патологии и предлагает возможные пути для терапии и профилактики заболевания.
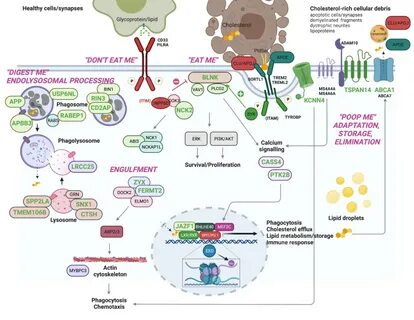
Ген ABCA7 кодирует белок, ответственный за транспорт липидов через клеточные мембраны, что критично для правильного функционирования нейронов. В исследовании учёные обнаружили, что редкие мутации в этом гене нарушают метаболизм липидов, в частности фосфатидилхолина, что приводит к изменениям в свойствах клеточных мембран, особенно митохондрий - "энергетических станций" клетки. Эти нарушения вызывают гипервозбудимость нейронов, повышенную уязвимость к окислительному стрессу и повреждение ДНК, что способствует развитию нейродегенеративных процессов. Предыдущие исследования уже выявили, что вариации в генной последовательности ABCA7 удваивают вероятность возникновения болезни Альцгеймера. Однако точные молекулярные пути действия этих вариантов оставались неясными до последних экспериментов.
Особенно интересно, что подобные нарушения липидного обмена ассоциируются и с более распространённым генетическим фактором риска - APOE4. Исследование MIT выявило, что сниженная функция белка ABCA7 приводит к изменению метаболизма фосфатидилхолина, ключевого компонента мембран нервных клеток, что влияет на их структурную гибкость и функциональность. Вследствие этого внутриклеточные митохондрии больше не способны эффективно регулировать избыток электростатического заряда, что вызывает накопление свободных радикалов и окислительный стресс. Последствия таких нарушений - снижение энергетической эффективности нейронов и повреждение их генетического материала. Для изучения влияния мутаций ABCA7 учёные использовали ткани нейронов, полученные от людей с редкими вариантами этого гена.
Они также создали нейроны из индуцированных плюрипотентных стволовых клеток (iPSC), введя туда мутации ABCA7. Эти лабораторные модели продемонстрировали сходные изменения в экспрессии генов и функциональном состоянии клеток. Один из наиважнейших результатов работы - возможность обращения патологических процессов с помощью лечения CDP-холином, предшественником фосфатидилхолина, важного строительного блока клеточных мембран. Обработка нейронных клеток с мутациями ABCA7 CDP-холином восстанавливала нормальную функцию мембран митохондрий, снижала окислительный стресс и уменьшала гипервозбудимость нейронов. Это свидетельствует о потенциале терапии, направленной на поддержание липидного гомеостаза для замедления или предотвращения прогрессирования болезни.
Кроме того, в моделях трехмерных органоидов из таких нейронов учёные обнаружили повышенный уровень бета-амилоида - белка, образующего характерные бляшки при болезни Альцгеймера. Лечение CDP-холином снизило образование этих патологических белков и улучшило функциональность нейронных структур. Следует отметить, что, помимо редких вариантов гена ABCA7, ученые обратили внимание и на более распространённый вариант, встречающийся примерно у 18% населения. Этот вариант, ранее считавшийся безвредным, также проявляет изменения в метаболизме липидов и может увеличить риск развития болезни. Таким образом, нарушения функции ABCA7 могут оказывать влияние на гораздо большую часть населения, чем предполагалось.
Исследования MIT подчеркивают важность липидного обмена в патогенезе болезни Альцгеймера и указывают на общие механизмы с такими известными факторами риска, как APOE4. Предварительные данные позволяют говорить о перспективности использования холиновых добавок для восстановления клеточного баланса и снижения нейродегенеративных изменений. Природные источники холина включают яйца, мясо, рыбу и некоторые бобовые и орехи. Повышение потребления холина через питание или добавки может стать простым и доступным способом профилактики для людей с генетической предрасположенностью. Руководитель исследования, Ли-Хуэй Цай, ранее показала эффективность CDP-холина в моделях с геном APOE4, а сейчас участвует в клинических испытаниях, оценивающих влияние холиновых добавок на носителей этого гена.
Это открывает горизонты для новых подходов к лечению и профилактике болезни Альцгеймера, основанных на восстановлении липидного гомеостаза. В целом, работа демонстрирует, что нарушения работы редких генов, таких как ABCA7, тесно связаны с ключевыми биологическими процессами, ведущими к нейродегенерации. Понимание этих связей расширяет наши знания о заболевании и позволяет развивать стратегии раннего вмешательства. Предстоящие исследования и клинические испытания помогут уточнить, насколько эффективны и безопасны холиновые препараты для снижения риска болезни Альцгеймера у различных категорий пациентов. Научный прогресс в этой области дает надежду на улучшение качества жизни миллионов людей и замедление или предотвращение когнитивных нарушений, вызванных этим тяжелым заболеванием.
Последние открытия MIT подтверждают важность комплексного подхода к изучению болезни Альцгеймера, объединяющего генетику, молекулярную биологию, метаболизм и нейронауку для создания эффективных терапевтических решений. .