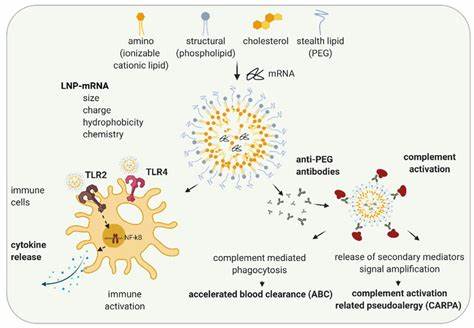
Воспалительные заболевания кишечника (ВЗК) остаются одной из наиболее актуальных проблем современной медицины, влияя на качество жизни миллионов людей по всему миру. Текущие методы лечения зачастую ограничены из-за побочных эффектов препаратов и недостаточной точности воздействия на воспалительный процесс. В связи с этим назревает необходимость разработки инновационных терапевтических средств, способных избирательно воздействовать на пораженные ткани и обеспечивать максимальную эффективность при минимальной токсичности. Одним из перспективных направлений является применение замороженных нуклеиновых кислот (LNA) в сочетании с липидными наночастицами (ЛНП) для доставки биологически активных молекул непосредственно в клетки кишечника, пораженного воспалением. Замороженные нуклеиновые кислоты представляют собой усовершенствованную форму антисмысловых олигонуклеотидов, обладающих высокой сродственностью и специфичностью к комплементарным последовательностям мРНК.
Благодаря химической модификации они характеризуются повышенной стабильностью и способностью эффективно блокировать синтез патологически активных белков. Однако важной проблемой было то, что для достижения терапевтического эффекта требовались высокие дозы, что повышало риск нежелательных побочных реакций. Революционным решением в этой области стало использование липидных наночастиц как транспортного средства для доставки LNA, что позволило значительно снизить необходимую дозировку и повысить безопасность применения. Липидные наночастицы представляют собой биосовместимые и биодеградируемые структуры, которые способны инкапсулировать нуклеиновые кислоты, защищая их от деградации в кровяном русле и обеспечивая одновременно удобство проникновения внутрь клеток-мишеней. Ключевой инновацией является применение ионизуемых липидов, обладающих способностью менять заряд в зависимости от рН среды.
Это позволяет ЛНП стабильно сохранять структуру в физиологических условиях и эффективно высвобождать сиРНК и LNA в кислой внутриклеточной среде эндосом, облегчая процесс эндосомального побега и высвобождение терапевтического агента в цитоплазму. Недавние исследования продемонстрировали разработку восьми уникальных типов ионизуемых липидов с разнообразными характеристиками по гидрофобности, биодеградации и зарядовым свойствам. Среди них лидирующие позиции по эффективности доставки LNA заняли липиды с линолеиновыми хвостами и биодеградируемыми сложными эфирами. Физико-химическая характеристика сформированных ЛНП показала, что размер частиц варьируется в пределах 50-70 нанометров, что считается оптимальным для системного введения и обеспечения тканевой специфичности. Кроме того, все наночастицы проявили высокую инкапсуляционную эффективность более 85% и низкий уровень цитотоксичности, что является важным показателем при разработке лекарственных форм.
Эксперименты in vitro с использованием моделей клеток, связанных с воспалением кишечника, включая макрофаги, колоректальные раковые клетки и фибробласты, показали, что ЛНП, состоящие из выбранных ионизируемых липидов, обеспечивают высокую эффективность проникновения и транспортировки LNA, что приводит к существенному изменению экспрессии мишеней. Особый интерес представил липид с обозначением "Липид 15", который продемонстрировал наивысший уровень "сплайсинг-скиппинга" (искусственного исключения экзона в предмРНК) во всех тестируемых клеточных линиях, значительно превосходя контрольные образцы. Crucial для дальнейшего подтверждения терапевтического потенциала, было проведение опытов in vivo на мышиной модели воспалительного колита, индуцированного сульфатом декстран-натрия (DSS). Введение ЛНП, загруженных антисмысловыми LNA, показало 30-кратное снижение требуемой дозы для достижения результата по сравнению с введением свободных LNA. При однократном введении системно формулировка с липидом 15 обеспечивала почти 100% эффективность в печени и значительную доставку в селезенку, а также проникновение в воспаленный кишечник.
Важным и новаторским шагом стало подтверждение распределения наночастиц во всем организме, с акцентом на колитическую ткань кишечника. Флуоресцентное мечение LNA в составе ЛНП позволило выявить их присутствие не только в печени, селезенке, почках и легких, но и в зоне воспаления кишечника. Более того, выделение клеточных популяций из слизистой кишечника выявило, что эндотелиальные клетки и ключевые иммунные эффекторные клетки - макрофаги и нейтрофилы - активно взаимодействуют с ЛНП, что указывает на возможность направленного воздействия на воспалительный процесс. Терапевтические исследования с использованием LNA, направленных на снижение экспрессии провоспалительного цитокина фактора некроза опухоли альфа (TNFα), продемонстрировали значительное улучшение клинических и гистологических параметров у мышей с индуцированным колитом. Применение LNA-LNP привело к снижению выраженности потери массы тела, уменьшению сокращения длины кишечника и снижению уровней воспалительных цитокинов как TNFα, IL-6 и IL-1β.
Гистологический анализ показал улучшение целостности эпителия и уменьшение инфильтрации лейкоцитов, что свидетельствует о позитивном влиянии терапии на морфофункциональное состояние тканей. Кроме эффективности, безопасность терапии была тщательно оценена. Биохимические показатели печени, такие как активности печеночных ферментов ALT, AST и ALP, оставались в пределах нормы без признаков гепатотоксичности. Кровяной профиль крови также не выявил изменений в параметрах лимфоцитов, мономеров и тромбоцитов, что дополнительно подтверждает хорошую переносимость лечения. Данное исследование подчеркивает значимость разработки целевых систем доставки с применением липидных наночастиц для улучшения фармакокинетики и фармакодинамики антисмысловых олигонуклеотидов.
Традиционные методы введения ASO сталкивались с проблемами эффективной доставки, недостаточной стабильности и риском токсичности, что сдерживало их широкое применение. Использование ЛНП позволяет минимизировать эти ограничения, повышая биодоступность и снижая дозу, необходимую для достижения терапевтического эффекта. Хотя накопленные данные внушительны, существует потенциал для дальнейшего совершенствования и оптимизации данных систем. Одна из перспектив - внедрение молекулярных мишеней, обеспечивающих активный таргетинг определенных клеточных популяций кишечника, включая патогенетически значимые иммунные и эпителиальные клетки. Активное таргетирование может улучшить терапевтическую эффективность и еще больше снизить риск системных побочных действий.
Кроме того, переход с острых моделей воспаления, таких как DSS-колит, на более сложные и клинически релевантные модели хронической ВЗК позволит лучше понять потенциал терапии и её долгосрочные эффекты. Это особенно важно для создания лечения, способного контролировать хронические процессы и предотвращать осложнения. В заключение, интеграция замороженных нуклеиновых кислот с инновационными липидными наночастицами открывает новые горизонты в лечении воспалительных заболеваний кишечника. Такая платформа доставки обеспечивает высокую специфичность, значительное снижение дозы лекарственного вещества и благоприятный профиль безопасности, что важно для будущих клинических разработок. Дальнейшие исследования и клинические испытания могут привести к появлению принципиально новых и эффективных медикаментов, способных изменить тактику лечения ВЗК и повысить качество жизни пациентов.
.