Научное исследование болезни Альцгеймера — одной из самых сложных и разрушительных неврологических патологий — постоянно вызывает живой интерес у медицинского сообщества и общественности. Более тридцати лет назад была опубликована знаковая статья, которая не только дала старт интенсивным исследованиям, но и сформировала основополагающую гипотезу развития заболевания — гипотезу амилоида. Эта статья представляла собой отчет о создании первого трансгенного мышиного организма, способного воспроизводить ключевые признаки болезни Альцгеймера, и стала фундаментом для последующих попыток лечения и разработки лекарственных препаратов. Несмотря на свой исторический статус и широкое признание, критический разбор этого исследования выявляет серьёзные недостатки и вопросы, которые до сих пор остаются актуальными и влияют на траекторию научных поисков и клинических испытаний. Болезнь Альцгеймера характеризуется постепенной потерей памяти, нарушением когнитивных функций и неизбежным снижением качества жизни пациентов.
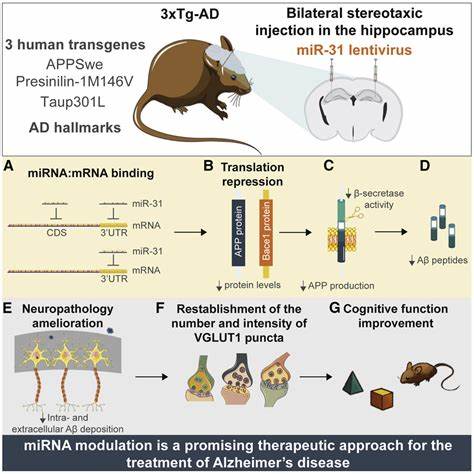
Основным биомаркером, связанным с заболеванием, считается накопление амилоидных бляшек и нейрофибриллярных клубков в головном мозге. Гипотеза амилоида предполагает, что именно образование и агрегация бета-амилоида запускают цепочку патологических событий, приводящих к нейродегенерации. Эта концепция, впервые предложенная в начале 1990-х годов, стала краеугольным камнем Alzheimer-исследований и фармакологических разработок. Создание модели болезни на мышах в 1995 году, известной как PDAPP-модель, вызвало настоящий фурор в научных кругах. Впервые удалось генетически модифицировать грызунов так, чтобы они продуцировали человеческий мутированный амилоидный прекурсорный белок APP, что приводило к появлению характерных амилоидных бляшек в мозге.
Этот успех символизировал большой шаг вперед — теперь терапевтические подходы можно было тестировать на биологически релевантной модели. Однако при детальном рассмотрении методологии и представленных данных начинают проступать существенные оговорки. Одной из ключевых проблем является неоправданно высокий уровень экспрессии мутированного APP. В PDAPP-мышах было интегрировано около сорока копий человеческого мутированного гена, в отличие от двух копий, естественных для человека. Такой мощный оверэкспрессинг может не только искусственно индуцировать образование амилоидных бляшек, но и нагружать нейроны чрезмерной продукцией белка, вызывая токсичность, не связанную с заболеванием.
Это ставит под сомнение, насколько модель соответствует естественным процессам, наблюдаемым у больных людей. Кроме того, в модели не наблюдалась одна из ключевых характеристик человеческого Альцгеймера — образование нейрофибриллярных клубков, связанных с белком тау. Их отсутствие означает, что модель воспроизводит лишь часть комплексной патологии, что усложняет интерпретацию полученных результатов и ограничивает применение модели для поиска эффективных лекарств. Критический взгляд на визуализацию бляшек и динамику их накопления в мозге PDAPP-моделей также выявляет пробелы. Изображения в оригинальной статье были представлены таким образом, что создать прямое сравнение с человеческой патологией было затруднительно.
Кроме того, вопрос о том, действительно ли амилоидные бляшки вызывают гибель нейронов или являются просто маркером повреждения, оставался не до конца раскрытым. Электронно-микроскопические данные показывали локализованный стресс отдельных нейрональных структур, однако отсутствие массовой нейродегенерации вблизи бляшек подрывало гипотезу о прямой нейротоксичности амилоида. Еще одним слабым местом модели было отсутствие поведенческих тестов, направленных на выявление когнитивных нарушений у трансгенных мышей. В человеческой патологии именно потеря памяти и ухудшение мыслительных способностей являются центральными симптомами, а не просто наличие бляшек. Без подтверждения подобных дефектов у животных невозможно утверждать, что модель адекватно воспроизводит болезнь на функциональном уровне.
Несмотря на эти значительные недостатки, модель PDAPP стала фундаментальной для фармацевтической индустрии. Компания Athena Neurosciences, ответственная за разработку модели, была быстро приобретена крупным биотехнологическим игроком Elan Corporation, и через несколько лет на основе полученных данных начались масштабные клинические испытания лекарств, нацеленных на снижение уровня амилоида в мозге. Эта ставка сопровождалась многомиллиардными инвестициями и высокой надеждой на прорыв. Однако реальные результаты клинических исследований часто разочаровывали: многие препараты либо не улучшали когнитивную функцию пациентов, либо приносили лишь минимальный эффект с сопутствующими серьезными побочными проявлениями. Одним из самых скандальных случаев стала ситуация с адукэнумабом — препаратом, получившим ускоренное одобрение FDA в 2021 году, несмотря на отсутствие убедительных доказательств его эффективности.
Впоследствии производитель отказался от масштабных маркетинговых кампаний, а страховые программы ограничили покрытие расходов на лечение только участниками клинических испытаний. Данный опыт показывает важность критического подхода к исходным научным исследованиям, на которых строятся гипотезы и разрабатываются лекарства. Методологические упущения и неполнота моделей могут привести к ошибочным выводам и огромным затратам ресурсов. К тому же культура публикаций исторически поощряла более линейное и упрощенное представление экспериментов, оставляя за скобками неудачи, изменения гипотез и неоднозначные результаты, что создает иллюзию однозначности. Современное научное сообщество начинает идти путем диверсификации подходов.
Альтернативные гипотезы, касающиеся роли тау-белков, воспалительных процессов, нарушения метаболизма глюкозы и даже идеи «диабета 3 типа», получают всё больше внимания. Исследования также стремятся к комплексному учету множественных патогенетических механизмов, что отражается в новых стратегиях комбинационной терапии. Переосмысление и критический анализ исторических работ, таких как 1995 года статья о PDAPP-мышах, имеют ключевое значение для построения более надежной и многогранной картины болезни Альцгеймера. Он служит напоминанием о важности научной скрупулезности, прозрачности и открытости к альтернативным трактовкам. В конечном счете, несмотря на все сложности и неоднозначности, постоянное стремление к улучшению моделей заболевания, повышение качества экспериментов и активное сотрудничество между фундаментальными и клиническими исследователями создают надежду на прорыв в лечении и понимании этого разрушительного недуга.
Наука движется вперед, хотя и порой с трудностями и задержками — и именно осознанный критический подход поможет ей найти верный путь.