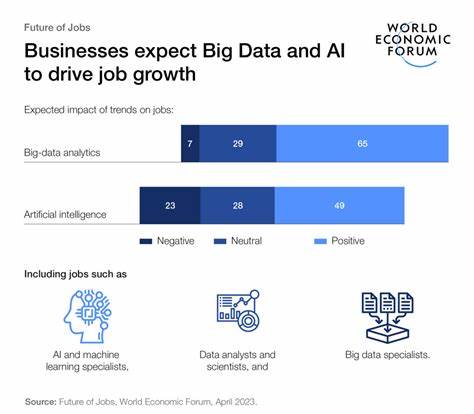
Гены, отвечающие за управление метаболизмом во время спячки у животных, становятся объектом интенсивных исследований в последние годы. Эти гены позволяют животным резко замедлять ход биологических процессов, сохранять энергию на длительное время и защищать органы от повреждений, вызванных изменениями кровотока. Удивительно, но подобные участки ДНК присутствуют и в человеческом геноме, что ставит вопрос о потенциальных «суперспособностях», скрытых в нашей биологии. Спячка — уникальное состояние организма, при котором замедляется дыхание и сердечный ритм, снижается температура тела, а обмен веществ перестраивается в экономный режим. У животных, таких как земляные белки, эти механизмы отточены миллионами лет эволюции.
Ученые обнаруживают, что главную роль в этом процессе играют определённые гены, связанные с регуляцией метаболизма и энергозатрат. В недавних исследованиях была выделена группа регуляторных элементов, известных как консервативные некодирующие цис-элементы (CREs). Они находятся возле генного кластера, именуемого локусом, связанным с массой жира и ожирением (FTO). Локус FTO уже давно привлекает внимание генетиков, поскольку мутации в этих областях связаны с риском развития ожирения и метаболических заболеваний у человека. Активность же CREs влияет на то, как именно работают эти гены, меняя вес, метаболизм и даже поведение в поисках пищи.
В результате экспериментов на грызунах с использованием технологии CRISPR ученые смогли отключить отдельные CREs и наблюдали, как изменялись весовые показатели, показатели обмена веществ и восстановление температуры тела после замедления метаболизма. Эти наблюдения важны не только для понимания биологии спячки, но и для изучения механизмов, лежащих в основе ожирения и диабета у людей. Одна из самых интересных особенностей животных, впадающих в спячку, — обратимая инсулинорезистентность. Перед началом спячки птицы и млекопитающие аккумулируют жир, но как только начинается период снижения метаболической активности, их чувствительность к инсулину восстанавливается. Для людей с диабетом второго типа понимание и умение управлять таким механизмом могло бы стать революционным достижением.
Еще одна важная область — нейропротекция. При выходе из спячки происходит внезапное возобновление кровотока в головном мозге, что у большинства животных вызывает повреждения, подобные инсультам. Однако у спящих животных это не происходит благодаря специфическим адаптациям, которые продолжают оставаться предметом исследований. Возможность обнаружить и использовать в медицине человека механизмы защиты мозга во время подобных восстановительных процессов открывает беспрецедентные перспективы. Несмотря на обнадеживающие данные, ученые отмечают, что человеческий организм не может входить в состояние глубокой спячки или даже торпора, которым обладают многие млекопитающие.
Однако гены, которые регулируют обмен веществ и энергетические процессы, присутствуют и у нас. Возможно, речь идет не о полном воссоздании спячки, а о целенаправленном использовании отдельных ее аспектов для лечения заболеваний или улучшения здоровья. Текущие исследования выдвигают идею о «генетическом хабе», управляющем многими процессами, связанными с метаболизмом и поведением, и связанном с генами спячки. Эксперименты на мышах показывают, что манипуляции с этими генами меняют не только физические параметры, но и сложные поведенческие реакции, такие как поиск пищи и адаптивность к стрессам. Это проливает свет на эволюционные механизмы и помогает глубже понять, почему одни виды развили способность к спячке, а другие — нет.
Одним из вызовов является адаптация этих выводов к человеческой физиологии. В организме человека наблюдаются сложные регулирующие системы, и простое изменение генных участков, как в лабораторных мышах, не всегда дает ожидаемый эффект. Понимание того, как и когда включаются те или иные гены, требует многолетней работы и широкого спектра исследований с использованием различных моделей. Перспективным направлением является разработка лекарственных препаратов, способных имитировать полезные эффекты генов, связанных со спячкой, без необходимости фактического погружения человека в состояние анабиоза. Такие препараты могут замедлять метаболизм, защищать мозг и другие органы и, возможно, привести к новым методам лечения сердечно-сосудистых заболеваний, диабета и неврологических патологий.
Исследования также могут открыть путь к снижению темпов старения и продлению здоровой жизни, так как многие процессы спячки направлены на сохранение тканей и предотвращение повреждений от окислительного стресса. Современные технологии, включая генно-инженерные методы и глубокое секвенирование, позволяют делать качественные шаги вперед в изучении этих сложных биологических процессов. Кроме того, понимание особенностей обмена веществ в спячке может помочь и в других сферах, например, в космической медицине, где состояние замедленного метаболизма может позволить астронавтам выдерживать длительные полеты без серьезных повреждений организма. Подводя итог, человеческий геном содержит скрытые возможности, связанные с генами, ответвленными от механизмов спячки животных. Они могут стать ключом к новым методам лечения и значительному улучшению качества жизни.
Продолжение исследований позволит раскрыть эти «суперспособности» и открыть новые горизонты в медицине и биологии человека.