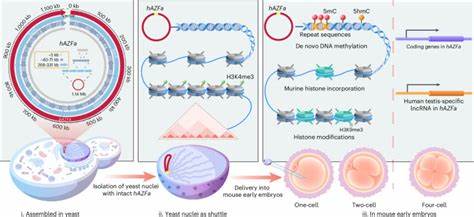
В последние годы развитие синтетической биологии и геномики стремительно прогрессирует, расширяя границы понимания и возможностей модификации генетического материала. Одним из наиболее впечатляющих достижений современной науки стала успешная сборка и доставка синтетической мегабазовой ДНК человека в ранние эмбрионы мышей, что стало возможным благодаря инновационному методу SynNICE. Эта технология кардинально меняет подходы к изучению эпигенетических процессов и регуляции генов, а также прокладывает путь к созданию синтетических человеческих хромосом в многоклеточных организмах. Традиционные исследования в области геномики сталкивались с ограничениями при работе с мегабазовыми сегментами ДНК — участками генома размером свыше миллиона базовых пар. Особенно непростой задачей было создание синтетических конструкций таких масштабов, а также надежное и точное их внедрение в клетки млекопитающих, чтобы изучать влияние на развитие и экспрессию генов.
Это объясняется высокой степенью повторяющихся последовательностей, сложностью обеспечения стабильной структуры и необходимостью сохранения функциональной хроматиновой организации ДНК. Разработка метода SynNICE стала переломным моментом. Он включает несколько ключевых этапов. Сначала происходит химический синтез фрагментов ДНК длиной около 5,5 тысяч баз. Эти фрагменты собираются с помощью специальных комбинационных стратегий в более крупные сегменты, размером от 40 до 70 килобаз, с использованием системы дрожжей Saccharomyces cerevisiae.
Дрожжи выступают в роли живого «фабричного» организма, способного собирать сложные многокомпонентные конструкции за счет своего аппарата гомологической рекомбинации. Особенностью собранных сегментов является высокая повторяемость, которая традиционно усложняла сборку, однако сочетание методов химического синтеза и стадийного рекомбинационного объединения позволило преодолеть эти барьеры. После формирования четырёх крупных фрагментов, их объединяют в единый мегабазовый конструкт размером примерно 1,14 мегабазы, представляющий собой участок человеческой Y-хромосомы, известный как локус AZFa, связанный с мужской фертильностью. Для предотвращения повреждения и деградации ДНК в процессе извлечения из дрожжевых клеток был использован разработанный метод NICE — выделение целых ядер дрожжей, сохраняющих хромосомную структуру. Такой подход позволяет сохранить естественную упаковку ДНК с нуклеосомами, что крайне важно для последующих эпигенетических процессов.
Доставку этих ядер в клетки эмбрионов мыши осуществляли методом микроинъекций в яйцеклетки в метафазе II. Впоследствии наблюдали за процессами ремоделирования хроматина, включающими замену дрожжевых гистонов на гистоны мыши и возникновение эпигенетических меток, таких как метилирование ДНК и модификации гистонов. Одной из важнейших находок стало спонтанное и избирательное метилирование синтетического человеческого ДНК в виде 5-метилцитозина, которое начиналось сразу с одноклеточной стадии эмбриона. Это метилирование преимущественно охватывало повторяющиеся последовательности — одно из ключевых свойств эпигенетической регуляции, обеспечивающей стабильность и подавление нежелательной транскрипционной активности. Интересно, что метилирование происходило без усиления традиционных гистоновых маркеров репрессии, таких как H3K9me3, что указывает на уникальные механизмы распознавания и модификации чужеродной ДНК.
Переход транскрипционной активности синтетического локуса AZFa выявлялся начиная с четырехклеточной стадии, регулируясь динамичным изменением уровней метилирования. При этом было показано, что подавление ДНК-метилтрансфераз и тен-элевен транслогаз (Tet) ферментов существенно влияет на активацию этих генов, что подтверждает центральную роль эпигенетических модификаций в управлении экспрессией урегулированных геномных участков. Исследование синтетической ДНК AZFa в эмбрионах мыши открывает перспективы для глубокого понимания основ формирования и наследования эпигеномных состояний, особенно с нуля — без предшествующих меток. Такой «де ново» подход позволяет исследовать принципы эпигенетической регуляции без влияния истории наследования хромосомных структур. Помимо фундаментальной науки, этот метод обладает огромным потенциалом для биомедицинских исследований.
Например, микроделеции AZFa на человеческой Y-хромосоме ассоциируются с тяжелыми формами мужского бесплодия, не имеющими клинического решения. Создание синтетических конструкций с модифицированными или восстановленными генами на базе AZFa может позволить моделировать болезнь и тестировать новые терапевтические стратегии. Дальности развития технологии интеллектуально связаны с созданием искусственных человеческих хромосом (Human Artificial Chromosomes — HAC). В отличие от вставок в существующие хромосомы или отдельных плазмид, искусственные хромосомы способны самостоятельно существовать и наследоваться, что дает возможность комплексной замены геномных участков и изучения многогенных регуляторных сетей. В техническом плане синтез мегабазовой ДНК и её стабильное содержание в дрожжах демонстрирует устойчивость и функциональную совместимость, несмотря на абсолютные эволюционные различия между людьми и дрожжами.
При этом синтетический участок локуса AZFa не влиял на рост дрожжевых клеток и лишь минимально изменял транскрипционный и протеомный профили хозяина, что подтверждается многоуровневым анализом – от РНК-секвенирования до протеомики и пространственной организации хроматина (Hi-C). Хранение и транспортировка таких гигантских молекул ДНК прежде представляли серьезные сложности из-за хрупкости и склонности к деградации. Метод NICE, позволяющий изолировать невредимые клетки и сохранять их до полугода в замороженном состоянии, значительно упрощает логистику и повышает эффективность экспериментов, расширяя возможности повторного использования и масштабирования методов. Инновационный подход доставки ядер дрожжей в эмбриональные клетки с последующим мониторингом динамики эпигенетических и транскрипционных изменений стал ключевым для понимания механизмов установления наследуемых модификаций и запуска функциональных генов. Прямое наблюдение замещения гистонов и модификаций Дмитрия по стадиям развития эмбрионов также позволило сделать выводы о времени и обстоятельствах настройки синтетической ДНК в контексте млекопитающего организма.
Подобные достижения открывают двери для разработки новых типов моделей изучения человеческих генов и их регуляции в условиях in vivo, что невозможно реализовать традиционными методами клонирования или фрагментарного внесения ДНК. Кроме того, создание основе синтетических мегабазовых участков может стать платформой для более сложных экспериментов с изменением кодирующих и некодирующих последовательностей, выявляя их роль в развитии, дифференцировке и патологиях. Несмотря на успехи, метод SynNICE и связанные технологии столкнуты с рядом вызовов. В частности, интеграция синтетических конструкций в хромосомное пространство организма-хозяина без геномных конфликтов и стабильное копирование синтетических сегментов во время деления клеток еще требуют оптимизации. Также предстоит лучше понять полностью ли соблюдаются принципы эпигенетической регуляции, присущие естественным хромосомам, и как можно повысить репликацию и наследуемость синтетических мегабазных хромосом.
Тем не менее уже сейчас можно смело утверждать, что разработка технологии сборки и доставки мегабазовой синтетической ДНК человека в мышиные эмбрионы знаменует собой новый этап в области геномного редактирования и синтетической биологии. Это не только фундаментальный прорыв в плане изучения базовых механизмов эпигенетики и регуляции транскрипции, но и отправная точка для создания новых терапевтических и исследовательских инструментов, позволяющих смоделировать человеческие заболевания на уровне целых хромосомных сегментов. Сфера применения таких технологий надеется на расширение возможностей в изучении сложных многогенных заболеваний, создании биологических «микромашин» с заданными функциями и даже разработке универсальных подходов к замене или корректировке утраченных генетических участков. В перспективе это может привести к революционным изменениям в лечении генетически обусловленных патологий и понимании сути человеческого развития и эволюции. Таким образом, SynNICE и связанные с ним исследования показывают, как современная биология шаг за шагом реализует идею написания, сборки и внедрения искусственного генома, раздвигая границы возможного и реализуя амбициозные концепции синтетической генетики на практике.
Открытия, сопряжённые с этой технологией, несомненно, повлияют на будущее медицины, биотехнологий и базовых наук, стимулируя дальнейшие исследования и разработки в области жизненных наук.