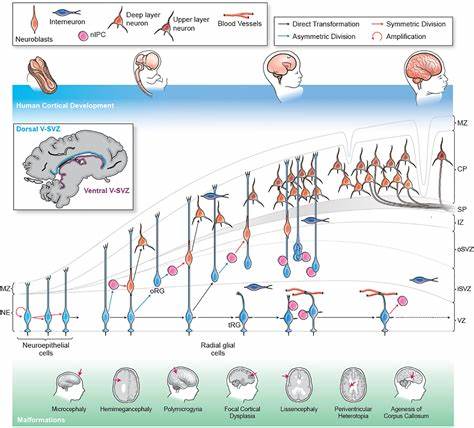
Кора головного мозга — это одна из самых сложных и важных структур в человеческом организме, отвечающая за высшие функции, включая мышление, память и восприятие. Нарушения в развитии коры могут привести к целому спектру неврологических и психиатрических заболеваний, включая микроцефалию, лиссэнцефалию, аутизм и шизофрению. Несмотря на значительные успехи в исследовании этих заболеваний, понимание их ранних причин и механизмов остается ограниченным из-за сложности человеческого мозга и трудностей в изучении ранних фаз развития. Современные подходы к моделированию нервной системы позволяют использовать человеческие нейрональные стволовые клетки (НСК) для воспроизведения ключевых этапов развития коры в контролируемых лабораторных условиях. Эти модели дают уникальную возможность изучать динамику генов, которые влияют на формирование и спецификацию клеток мозга, а также выявлять критические периоды, когда нейрональные стволовые клетки наиболее уязвимы для генетических или средовых нарушений.
Исследования последних лет показывают, что болезни коры не ограничиваются нарушениями в зрелых нейронах. Ключевую роль в их возникновении играют ранние стадии развития нейрональных стволовых клеток и клеток-организаторов мозга, которые задают пространственно-временную идентичность клеток коры. Например, гены, ассоциированные с такими заболеваниями, как микроцефалия или гидроцефалия, интенсивно экспрессируются на этапах, когда нейрональные стволовые клетки активно делятся и начинают принимать специфические функциональные пути. Особое внимание уделяется влиянию транскрипционных факторов — белков, которые регулируют экспрессию других генов и формируют сложные сети на протяжении развития мозга. Нарушения в работе таких факторов, как FOXG1, MEIS2, POU3F2 и других, часто связаны с дебютом нейроразвитийных нарушений, таких как аутизм.
Модели человеческих нейрональных стволовых клеток позволяют воссоздать и манипулировать активностью этих факторов и проследить их влияние на судьбы клеток в процессе формирования коры. Одним из важных преимуществ применения стволовых клеток является возможность создания индивидуализированных моделей болезни — клеток, полученных из пациентов с определёнными генетическими нарушениями. Это дает шанс понять, как уникальные геномные вариации воздействуют на раннее развитие коры и формируют фенотип заболевания. В частности, исследования нейрональных стволовых клеток пациентов с аутизмом выявляют выраженную изменённость в экспрессии генов, отвечающих за региональное паттернирование мозга и дифференцировку нейронов. Интеграция данных, полученных в результате моделирования заболеваний на нейрональных стволовых клетках с высокоточным секвенированием и методами анализа генных регуляторных сетей, позволяет выявлять ключевые узлы в контроле развития коры.
Такие узлы могут выступать мишенями для будущих терапевтических вмешательств. Например, факторы семейства Круppel-подобных факторов (KLF) оказываются центральными регуляторами, пересекающимися в различных заболеваниях и оказывающими влияние на несколько клеточных линий развития коры. Кроме того, имитация на компьютере потери функции этих ключевых транскрипционных факторов раскрывает, как именно нарушается дифференциация нейрональных стволовых клеток и миграция нейронов, что ведёт к появлению различных паттернов повреждений и симптомов. Такие симуляции помогут лучше понять разные клинические проявления при схожих генетических изменениях и подчеркнуть значимость временного и пространственного контекста нарушения. Однако важно отметить, что хотя модели на нейрональных стволовых клетках предоставляют ценные сведения, они пока не могут полноценно воспроизвести всю сложность человеческого мозга.
Применение мультиомных подходов, включающих анализ транскриптома, эпигенома, а также взаимодействия между клетками, в сочетании с данными от живых тканей и животных моделей, служит залогом всестороннего понимания нейроразвитийных заболеваний. Перспективы применения данных исследований огромны. Освещение ранних критических фаз развития коры создаёт возможности для ранней диагностики и разработки персонализированных стратегий терапии, нацеленных на восстановление нормального функционирования нейрональных стволовых клеток. Это особенно актуально для таких заболеваний, как аутизм, где традиционные подходы лечения часто оказываются недостаточно эффективными из-за вариабельности проявлений и многогенного характера патологии. В будущем внедрение технологий одноклеточного секвенирования, машинного обучения и нанесения высокоточной метки генетическим траекториям в сочетании с культуральными моделями нейрональных стволовых клеток позволит детальнее рассматривать индивидуальные особенности развития заболевания у каждого пациента.
Это может стать основой для разработки новых биомаркеров и направленных лекарственных средств. Таким образом, исследование ранних этапов развития корковых нарушений с использованием моделей человеческих нейрональных стволовых клеток предоставляет глубокое понимание генетических и молекулярных основ сложных мозговых заболеваний. Эти модели открывают перед наукой путь для создания эффективных и персонализированных методов лечения, способных изменить ход развития неврологических и психиатрических заболеваний.