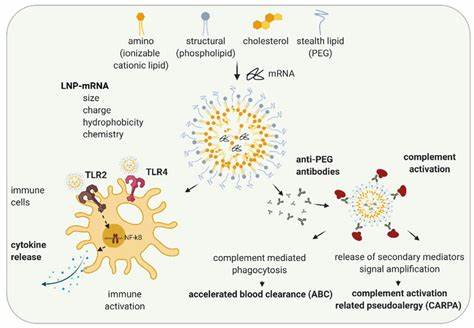
Воспалительные заболевания кишечника (ВЗК), включающие язвенный колит и болезнь Крона, являются серьезной проблемой современного здравоохранения. Эти хронические заболевания характеризуются воспалением слизистой оболочки кишечника, что приводит к болезненным симптомам и значительно снижает качество жизни пациентов. Современные терапевтические подходы зачастую ограничены серьезными побочными эффектами и недостаточной эффективностью. В связи с этим поиск новых, точечных методов лечения является приоритетной задачей науки и медицины. Одним из наиболее перспективных направлений в терапии ВЗК сегодня считается использование закрепленных нуклеиновых кислот (locked nucleic acids, LNA).
Эти молекулы представляют собой усовершенствованную версию традиционных антисмысловых олигонуклеотидов, обладающих высокой специфичностью и способностью к сильному связыванию с целевыми последовательностями РНК. Такой механизм позволяет эффективно подавлять экспрессию генов, участвующих в воспалительном процессе. Закрепленные нуклеиновые кислоты отличаются от обычных ОНО (антисмысловых олигонуклеотидов) особой структурной жесткостью, которая обеспечивается введением химического моста в состав сахарного кольца. Этот структурный элемент значительно повышает сродство LNA к комплементарным нуклеиновым кислотам, что делает их чрезвычайно эффективными при модификации экспрессии целевых генов. Однако данный эффект может сопровождаться затруднением проникновения в клетки и потенциалом офф-таргетных взаимодействий, что ограничивает применение LNA при системном введении.
Преодолеть эти ограничения помогает использование липидных наночастиц (lipid nanoparticles, LNP). Эти наночастицы обладают уникальными физико-химическими свойствами, которые обеспечивают эффективную и безопасную доставку нуклеиновых кислот к целевым тканям. Суть метода заключается в инкапсуляции LNA внутрь LNP, что позволяет защитить биомолекулы от деградации в кровотоке, способствует обходу биологических барьеров и повышает попадание в клетки-мишени. Ключевым компонентом LNP являются ионизируемые липиды, которые при физиологическом pH нейтральны, а при кислотной среде, характерной для эндосом клетки, приобретают положительный заряд. Такая особенность способствует эффективному высвобождению содержимого из эндосом в цитоплазму, где закрепленные нуклеиновые кислоты начинают осуществлять подавление экспрессии целевых молекул, таких как провоспалительные цитокины.
Недавние исследования, проведённые на модельных организмах, показали впечатляющие результаты по снижению воспаления кишечника с применением LNA, доставляемых через LNP. В экспериментах с мышами, у которых индуцировали колит с помощью вещества Dextran Sodium Sulfate, применение LNP с инкапсулированной LNA, направленной против фактора некроза опухоли альфа (TNFα), привело к существенному снижению тяжести заболевания. При этом, доза LNA, необходимая для достижения терапевтического эффекта, была снижена в 30 раз по сравнению с введением необработанных LNA. Sиндром воспаления кишечника непосредственно связан с избыточной продукцией цитокинов, таких как TNFα, IL-6 и IL-1β. Традиционные препараты, направленные на блокирование TNFα, например моноклональные антитела, обладают высокой эффективностью, но ограничены нежелательными реакциями и высокой стоимостью.
LNA-LNP терапия открывает возможность селективного уменьшения уровней патологических медиаторов за счет избирательного подавления их мРНК прямо в тканях воспаления. Кроме того, липидные наночастицы демонстрируют способность выбираться в воспаленные участки кишечника, в том числе связываться с клетками эндотелия, макрофагами и нейтрофилами - ключевыми участниками воспалительного процесса. Любопытно, что в инфицированных или воспаленных тканях проницаемость сосудистого барьера и активация иммунных клеток способствует повышенному накоплению LNP, что дополнительно усиливает терапевтический эффект. Преимущества системы доставки LNA посредством LNP не ограничиваются лишь эффективностью. Безопасность применения также играет решающую роль.
Лечение с низкими дозировками LNA снижает риск токсического воздействия на печень, что подтверждается нормальными уровнями печеночных ферментов (АЛТ, АСТ, ЩФ) в экспериментах на животных. Это преимущество особенно важно в свете известных примеров гепатотоксичности классических LNA, которые предъявляют определённые ограничения для клинического использования. Подходы с использованием LNP для доставки генетических препаратов получили широкое признание после успеха мРНК-вакцин против COVID-19, что подтверждает высокий потенциал этих наночастиц для терапии различных заболеваний. Совместимость LNP с LNA открывает новые перспективы для лечения не только кишечных воспалений, но и других патологий, требующих молекулярного вмешательства. Для успешного вывода на клинический уровень необходим ряд дополнительных исследований, включая детальное изучение фармакокинетики, биораспределения и возможных иммунных реакций.
В частности, планируется разработка модифицированных LNP с активным таргетированием на специфические популяции клеток кишечника, чтобы повысить селективность действия и минимизировать системные эффекты. Кроме того, переход на более сложные и приближенные к человеческим моделям колита позволит оценить эффективность и безопасность терапии на более реалистичных условиях. Подобные исследования, а также масштабируемое производство препаратов, учитывающее все требования GMP, будут ключевыми этапами на пути к применению в клинике. Таким образом, использование закрепленных нуклеиновых кислот в сочетании с инновационными липидными наночастицами представляет собой перспективное направление в лечении воспалительных заболеваний кишечника. Терапия обещает увеличить эффективность, снизить дозы лекарственных средств, уменьшить побочные эффекты и улучшить качество жизни пациентов.
Совокупность клинических и биотехнологических достижений в этой области формирует фундамент для следующих поколений нуклеиново-кислотных препаратов, открывающих новые возможности для медицины будущего. .